
ЎѕМвДїЎїПаН¬ОВ¶ИЎўПаН¬ИЭ»эµДЛДёцГЬ±ХИЭЖчЦРЅшРРН¬СщµДїЙДж·ґУ¦Јє2X(g)+Y(g)![]() 3W(g)+2Z(g) ЎчH=©ЃQ KJ/molЈ¬ЖрКјК±ідИлЖшМеµДОпЦКµДБїј°ЖЅєвК±МеПµДЬБї±д»ЇКэѕЭИз±нЈ¬ПВБРЛµ·ЁХэИ·µДКЗЈЁЎЎЎЎЈ©
3W(g)+2Z(g) ЎчH=©ЃQ KJ/molЈ¬ЖрКјК±ідИлЖшМеµДОпЦКµДБїј°ЖЅєвК±МеПµДЬБї±д»ЇКэѕЭИз±нЈ¬ПВБРЛµ·ЁХэИ·µДКЗЈЁЎЎЎЎЈ©
X | Y | W | Z | ·ґУ¦МеПµДЬБї±д»Ї | |
јЧ | 2mol | 1mol | ·Еіцa kJ/mol | ||
ТТ | 1mol | 1mol | ·Еіцb kJ/mol | ||
±ы | 2mol | 2mol | ·Еіцc kJ/mol | ||
¶Ў | 3mol | 2mol | ОьКХd kJ/mol |
A.XµДЧЄ»ЇВКОЄЈєјЧЈјТТЈј±ы
B.c+dЈјQ
C.ЖЅєвК±Ј¬јЧИЭЖчЦРµД·ґУ¦ЛЩВК±И¶ЎИЭЖчЦРµДВэ
D.ЖЅєвК±±ыИЭЖчЦРZµДОпЦКµДБїЕЁ¶ИЧоґу
Ўѕґр°ёЎїD
ЎѕЅвОцЎї
AЈ®±ыµДОпЦКµДБїКЗТТµД2±¶Ј¬ОпЦКµДБїФцґуЈ¬С№ЗїФцґуЈ¬ЧЄ»ЇВКјхРЎЈ¬ФтЧЄ»ЇВКТТ>±ыЈ»јЧТТПа±ИЈ¬јЧЦРФцґуБЛXµДОпЦКµДБїЈ¬ФтXµДЧЄ»ЇВКјхРЎЈ¬ФтЧЄ»ЇВКјЧЈјТТЈ»±ыµДОпЦКµДБїПаµ±УЪФЪјЧµД»щґЎЙПФцјУБЛYЈ¬ФтXµДЧЄ»ЇВКФцґуЈ¬јЧЈј±ыЈ¬ЛщТФXµДЧЄ»ЇВКОЄЈєТТ>±ы>јЧЈ¬№КAґнОуЈ»
BЈ®јЧ¶ЎКфУЪµИР§ЖЅєвЈ¬¶юХЯ·ґУ¦·ЅПтПа·ґЈ¬¶юХЯµДЧЄ»ЇВКЦ®єНОЄ100%Ј¬ФтјЧ¶ЎИИБїЦ®єНОЄQЈ¬±ыµДјУИлYµДБїґуУЪјЧЈ¬ПтХэ·ЅПтЅшРРµДіМ¶ИґуЈ¬ЛщТФ±ы·ЕіцµДИИБїґуУЪјЧЈ¬Фт±ы¶ЎИИБїЦ®єНґуУЪQЈ¬јґc+d>QЈ¬№КBґнОуЈ»
CЈ®ёщѕЭ·ґУ¦2X(g)+Y(g)![]() 3W(g)+2Z(g)їЙЦЄЈ¬ФЪєгОВєгИЭМхјюПВЈ¬іхКјК±2molXЎў1molYПаµ±УЪјУИл3molWЎў2molZЈ¬¶юХЯБЅёцЖЅєв»ҐОЄµИР§ЖЅєвЈ¬ФтЖЅєвК±ёчЧй·ЦЕЁ¶ИПаµИЈ¬ЛщТФЖЅєвК±јЧЎў¶ЎИЭЖчЦРµД·ґУ¦ЛЩВКПаµИЈ¬№КCґнОуЈ»
3W(g)+2Z(g)їЙЦЄЈ¬ФЪєгОВєгИЭМхјюПВЈ¬іхКјК±2molXЎў1molYПаµ±УЪјУИл3molWЎў2molZЈ¬¶юХЯБЅёцЖЅєв»ҐОЄµИР§ЖЅєвЈ¬ФтЖЅєвК±ёчЧй·ЦЕЁ¶ИПаµИЈ¬ЛщТФЖЅєвК±јЧЎў¶ЎИЭЖчЦРµД·ґУ¦ЛЩВКПаµИЈ¬№КCґнОуЈ»
DЈ®±ыЦРїЙТФїґЧчПИјУИл2molXєН1molYЈ¬ЖЅєвєуУЦјУБЛ1molYЈ¬Фцґу·ґУ¦ОпµДЕЁ¶ИЖЅєвХэПтТЖ¶ЇЈ¬ЛщТФЙъіЙОпµДЕЁ¶ИФцґуЈ¬јґ±ыЦРZµДОпЦКµДБїЕЁ¶ИЧоґуЈ¬№КDХэИ·Ј»
№Кґр°ёОЄЈєDЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї2000ДкЕµ±ґ¶ы»ЇС§Ѕ±КЪУиБЅО»ГА№ъ»ЇС§јТєНТ»О»ИХ±ѕ»ЇС§јТЈ¬ТФ±нХГЛыГЗФЪµјµзЛЬБПБмУтµД№±ПЧЈ¬ЛыГЗКЧПИ°СѕЫТТИІКчЦ¬ЦЖіЙµјµзЛЬБПЈ¬ПВБР№ШУЪѕЫТТИІµДРрКцґнОуµДКЗЈЁЎЎЎЎЈ©
A. ѕЫТТИІКЗТФТТИІОЄµҐМе·ўЙъјУѕЫ·ґУ¦РОіЙµДёЯѕЫОп
B. ѕЫТТИІµД»ЇС§КЅОЄ![]()
C. ѕЫТТИІКЗТ»ЦЦМјФЧУЦ®јдТФµҐЛ«јьЅ»МжЅбєПµДБґЧґЅб№№µДОпЦК
D. ѕЫТТИІКчЦ¬І»јУИОєОМоідОпјґїЙіЙОЄµзµДБјµјМе
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї7.8їЛ№эСх»ЇДЖ№ММеФЪіЈОВµНС№ПВЈ¬УлТ»¶ЁБїµДЛ®ХфЖш·ґУ¦Ј¬ЧоЦХµГµЅ№ММе16.8їЛЈ¬ґЛ№ММеОпЦКЦРТ»¶Ёє¬УР
A.NaOHЎ¤H2OB.NaOHC.Na2O2Ў¤2H2OD.Na2O2Ў¤8H2O
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї25 ЎжК±УР№ШОпЦКµДСХЙ«єНИЬ¶И»эЈЁKspЈ©ИзПВ±нЈє
ОпЦК | AgCl | AgBr | AgI | Ag2S |
СХЙ« | °Ч | µ»Ж | »Ж | єЪ |
Ksp | 1.8ЎБ10Ј10 | 7.7ЎБ10Ј13 | 1.5ЎБ10Ј16 | 1.8ЎБ10Ј50 |
ПВБРРрКцЦРІ»ХэИ·µДКЗЈЁЎЎЎЎЈ©
A.ПтAgClµД°ЧЙ«РьЧЗТєЦРјУИл0.1 mol/L KIИЬТєЈ¬УР»ЖЙ«іБµнІъЙъ
B.25 ЎжК±Ј¬АыУГ±нЦРµДИЬ¶И»эЈЁKspЈ©Ј¬їЙТФјЖЛгAgClЎўAgBrЎўAgIЎўAg2S±ҐєНЛ®ИЬТєЦРAgЈ«µДЕЁ¶И
C.25 ЎжЈ¬AgCl№ММе·Ц±рФЪµИОпЦКµДБїЕЁ¶ИNaClЎўCaCl2ИЬТєЦРИЬЅвґпµЅЖЅєвЈ¬БЅИЬТєЦРЈ¬cЈЁAg+Ј©єНИЬ¶И»эѕщПаН¬
D.ФЪ5 mL 1.8ЎБ10Ј6 mol/L NaClИЬТєЦРЈ¬јУИл1µОЈЁ20µОФјОЄ1 mLЈ©1ЎБ10Ј3 mol/L AgNO3ИЬТєЈ¬І»ДЬІъЙъ°ЧЙ«іБµн
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї25 ЎжК±Ј¬ПВБРУР№ШИЬТєЦРОўБЈµДОпЦКµДБїЕЁ¶И№ШПµХэИ·µДКЗЈЁЎЎЎЎЈ©
A.0.1 molЎ¤LЈ1(NH4)2Fe(SO4)2ИЬТєЦРЈєc(![]() )>c(
)>c(![]() )>c(Fe2Ј«)>c(HЈ«)
)>c(Fe2Ј«)>c(HЈ«)
B.pHЈЅ11µД°±Л®єНpHЈЅ3µДСОЛбИЬТєµИМе»э»мєПЈ¬ЛщµГИЬТєЦРЈєc(ClЈ)>c(![]() )>c(OHЈ)>c(HЈ«)
)>c(OHЈ)>c(HЈ«)
C.ФЪ0.1 molЎ¤LЈ1 Na2CO3ИЬТєЦРЈє2c(NaЈ«)ЈЅc(![]() )Ј«c(
)Ј«c(![]() )Ј«c(H2CO3)
)Ј«c(H2CO3)
D.0.1 molЎ¤LЈ1µДґЧЛбДЖИЬТє20 mLУл0.1 molЎ¤LЈ1СОЛб10 mL»мєПєуИЬТєПФЛбРФЈєc(CH3COOЈ)> c(ClЈ)> c(CH3COOH)> c(HЈ«)
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїБт»ЇДЖКЗЦШТЄµД»Ї№¤ФБПЈ¬ґу¶аІЙУГОЮЛ®ГўПхЈЁNa2SO4Ј©ЎЄМї·Ы»№Ф·ЁЦЖ±ёЈ¬ФАнОЄNa2SO4Ј«2C![]() Na2SЈ«2CO2ЎьЎЈЖдЦчТЄБчіМИзПВЈє
Na2SЈ«2CO2ЎьЎЈЖдЦчТЄБчіМИзПВЈє

ЈЁ1Ј© Na2SИЬТєПФјоРФЈ¬РґіцПа№Ш·ґУ¦µД·ЅіМКЅЈЁЦчТЄЈ©______Ј¬ЙПКцБчіМЦРІЙУГПЎјоТє±ИУГИИЛ®ёьєГЈ¬АнУЙКЗ___________ЎЈ
ЈЁ2Ј©іЈОВПВЈ¬µИМе»эЎўµИОпЦКµДБїЕЁ¶ИµДNaHSИЬТєУлNa2SИЬТє»мєПЈ¬»мєПИЬТєЦРc(S2Ј)_____c(HSЈ) ЈЁМоЎ°ґуУЪЎ±ЎўЎ°РЎУЪЎ±»тЎ°µИУЪЎ±Ј©ЎЈИф»мєПИЬТєµДpH=10Ј¬Фтc(HSЈ)Ј«3c(H2S)Јc(S2Ј)= ___________________
ЈЁ3Ј©ТСЦЄЈєI2Ј«2S2O32-=2IЈЈ«S4O62-ЎЈЙПКцЛщЦЖµГµДNa2SЎ¤9H2Oѕ§МеЦРє¬УРNa2S2O3Ў¤5H2OµИФУЦКЎЈОЄІв¶ЁІъЖ·µДіЙ·ЦЈ¬ЅшРРПВБРКµСйЈ¬ІЅЦиИзПВЈє
a. ИЎКФСщ10.00 gЕдіЙ500.00 mLИЬТєЎЈ
b. ИЎЛщЕдИЬТє25.00 mLУЪµвБїЖїЦРЈ¬јУИл№эБїZnCO3РьЧЗТєіэИҐNa2SєуЈ¬№эВЛЈ¬ПтВЛТєЦРµОИл2Ў«3µОµн·ЫИЬТєЈ¬УГ0.050 00 molЎ¤LЈ1I2ИЬТєµО¶ЁЦБЦХµгЈ¬УГИҐ5.00mL I2ИЬТєЎЈ
c. ФЩИЎЛщЕдИЬТє25.00 mLУЪµвБїЖїЦРЈ¬јУИл50.00 mL 0.050 00 molЎ¤LЈ1µДI2ИЬТєЈ¬ІўµОИл2Ў«3µОµн·ЫИЬТєЈ¬ХсµґЎЈУГ±кЧјNa2S2O3ИЬТєµО¶Ё¶аУаµДI2Ј¬УГИҐ15.00 mL 0.100 0 molЎ¤LЈ1 Na2S2O3ИЬТєЎЈ
ўЩІЅЦиbЦРУГZnCO3іэИҐNa2SµДАлЧУ·ЅіМКЅОЄ________ЎЈ
ўЪЕР¶ПІЅЦиcЦРµО¶ЁЦХµгµД·Ѕ·ЁОЄ______________ЎЈ
ўЫјЖЛгКФСщЦРNa2SЎ¤9H2OєНNa2S2O3Ў¤5H2OµДЦКБї·ЦКэ_________ЈЁРґіцјЖЛг№эіМЈ©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪТ»¶ЁМе»эИЭЖчЦР·ўЙъ·ґУ¦Јє2CH4ЈЁgЈ©+2NH3ЈЁgЈ©+3O2ЈЁgЈ©=2HCNЈЁgЈ©+6H2OЈЁgЈ©Ј¬15·ЦЦУДЪІвµГ·ґУ¦ЛЩВКУГHCN±нКѕОЄv(HCN)=0.36 mol/(LЎ¤min)Ј¬ёГ¶ОК±јдДЪПВБР±нКѕХэИ·µДКЗ( )
A.15·ЦЦУДЪ·ґУ¦ПыєД°±Жш5.4 mol
B.ёГК±јдДЪїЙУГЛ®±нКѕ·ґУ¦ЛЩВКОЄv(H2O)=1.08 mol/(LЎ¤min)
C.ёчОпЦКµДЛЩВК№ШПµУРЈє2v(CH4)=2v(NH3)=3v(O2)
D.15·ЦЦУДЪСхЖшЕЁ¶ИПВЅµ8.1 mol/L
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїQЎўRЎўXЎўYЎўZОеЦЦФЄЛШµДФЧУРтКэТАґОµЭФцЎЈТСЦЄЈєўЩZµДФЧУРтКэОЄ26Ј¬ЖдУаµДѕщОЄ¶МЦЬЖЪЦчЧеФЄЛШЈ»ўЪYФЧУјЫµзЧУЈЁНвО§µзЧУЈ©ЕЕІјmsnmpn ўЫRФЧУєЛНвLІгµзЧУКэОЄЖжКэЈ»ўЬQЎўXФЧУp№мµАµДµзЧУКэ·Ц±рОЄ2єН4ЎЈЗл»ШґрПВБРОКМвЈє
ЈЁ1Ј©R3- µДєЛНвµзЧУЕЕІјКЅКЗ____________________________Ј»
ЈЁ2Ј©РґіцZ(OH)3јУИИµД»ЇС§·ЅіМКЅ_________________________Ј»
ЈЁ3Ј©QУлYРОіЙµДЧојтµҐЖшМ¬Зв»ЇОп·Ц±рОЄјЧЎўТТЈ¬ПВБРЕР¶ПХэИ·µДКЗ________Ј¬
aЈ®ОИ¶ЁРФЈєјЧ>ТТЈ¬·РµгЈєјЧ>ТТ bЈ®ОИ¶ЁРФЈєјЧ>ТТЈ¬·РµгЈєјЧ<ТТ
cЈ®ОИ¶ЁРФЈєјЧ<ТТЈ¬·РµгЈєјЧ<ТТ dЈ®ОИ¶ЁРФЈєјЧ<ТТЈ¬·РµгЈєјЧ>ТТ
ЈЁ4Ј©QЎўRЎўYИэЦЦФЄЛШµДФЧУ°лѕ¶ґУґуµЅРЎµДЛіРтОЄ____________ЈЁУГФЄЛШ·ыєЕЧчґрЈ©
ЈЁ5Ј©QµДТ»ЦЦЗв»ЇОпПа¶Ф·ЦЧУЦКБїОЄ26Ј¬ЖдµзЧУКЅОЄ__________________
ЈЁ6Ј©XєНYРОіЙµД»ЇєПОпѕ§МеКфУЪ____________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіН¬С§ФЪКµСйКТЅшРРМъСОУлСЗМъСОП໥ת»ЇµДКµСйЈє
КµСйIЈєЅ«Fe3+ЧЄ»ЇОЄFe2+
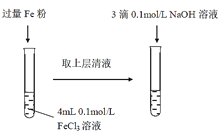
ЈЁ1Ј©іЈОВПВЈ¬FeCl3ИЬТєПФЛбРФЈ¬УГАлЧУ·ЅіМКЅ±нКѕЖдПФЛбРФµДФТт___ЎЈ
ЈЁ2Ј©Fe3+УлFe·Ы·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄ___ЎЈ
ЈЁ3Ј©µОјУNaOHИЬТє№ЫІмµЅµДПЦПуОЄ___ЎЈ
КµСйIIЈєЅ«Fe2+ЧЄ»ЇОЄFe3+
КµСй·Ѕ°ё | ПЦПу |
Пт3mL0.1mol/LFeSO4ИЬТєЦРјУИл1mL8mol/LПЎПхЛб | ИЬТє±дОЄЧШЙ«Ј¬·ЕЦГТ»¶ОК±јдєуЈ¬ЧШЙ«ПыК§Ј¬ИЬТє±дОЄ»ЖЙ« |
МЅѕїЙПКцПЦПуіцПЦµДФТтЈє
ІйФДЧКБПЈєFe2++NO![]() Fe(NO)2+ЈЁЧШЙ«Ј©
Fe(NO)2+ЈЁЧШЙ«Ј©
ЈЁ4Ј©УГАлЧУ·ЅіМКЅЅвКНNOІъЙъµДФТт___ЎЈ
ЈЁ5Ј©ґУ»ЇС§·ґУ¦ПЮ¶ИµДЅЗ¶И¶ФМеПµЦРґжФЪµД·ґУ¦ЅшРР·ґУ¦IЈєFe2+УлHNO3·ґУ¦Ј»·ґУ¦IIЈєFe2+УлNO·ґУ¦
ўЩТТИПОЄ·ґУ¦IКЗТ»ёцІ»їЙДж·ґУ¦Ј¬ІўНЁ№эКµСйЦ¤ГчЖдІВІвХэИ·Ј¬ТТЙијЖµДКµСй·Ѕ°ёКЗ___ЎЈ
ўЪІйФДЧКБП·ґУ¦IµДЛЩВК±И·ґУ¦IIВэЈ¬ЗлУГ»ЇС§ЖЅєвТЖ¶ЇФАнЅвКНИЬТєУЙЧШЙ«±дОЄ»ЖЙ«µДФТт___ЎЈ
ЈЁ6Ј©±ыИПОЄИфЙъіЙµДNOУлFe2+І»ЅУґҐЈ¬ИЬТєѕНІ»»біцПЦЧШЙ«Ј¬Зл»іцКµСйЧ°ЦГНјЈ¬КµПЦFe2+![]() Fe3+µДЧЄ»ЇЈ¬Н¬К±±ЬГвіцПЦґЛТміЈПЦПуЎЈ___
Fe3+µДЧЄ»ЇЈ¬Н¬К±±ЬГвіцПЦґЛТміЈПЦПуЎЈ___
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com