
����Ŀ��Q��R��X��Y��Z����Ԫ�ص�ԭ���������ε�������֪����Z��ԭ������Ϊ26������ľ�Ϊ����������Ԫ�أ���Yԭ�Ӽ۵��ӣ���Χ���ӣ��Ų�msnmpn ��Rԭ�Ӻ���L�������Ϊ��������Q��Xԭ��p����ĵ������ֱ�Ϊ2��4����ش��������⣺
��1��R3- �ĺ�������Ų�ʽ��____________________________��
��2��д��Z(OH)3���ȵĻ�ѧ����ʽ_________________________��
��3��Q��Y�γɵ������̬�⻯��ֱ�Ϊ�ס��ң������ж���ȷ����________��
a���ȶ��ԣ���>�ң��е㣺��>�� b���ȶ��ԣ���>�ң��е㣺��<��
c���ȶ��ԣ���<�ң��е㣺��<�� d���ȶ��ԣ���<�ң��е㣺��>��
��4��Q��R��Y����Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳��Ϊ____________����Ԫ�ط�������
��5��Q��һ���⻯����Է�������Ϊ26�������ʽΪ__________________
��6��X��Y�γɵĻ����ᄃ������____________��
���𰸡�1S22S22P6 ![]() b Si �� C �� N H��C����C��H ԭ�Ӿ���
b Si �� C �� N H��C����C��H ԭ�Ӿ���
��������
Z��ԭ������Ϊ26����ZΪFeԪ�أ�Q��R��X��Y��Ϊ����������Ԫ�أ�Q��R��X��Y��Z����Ԫ�ص�ԭ���������ε�����Q��X��p���Ϊ2��4��������2�����Ӳ㣬��ΪQΪCԪ�غ�XΪOԪ�أ�Yԭ�Ӽ۵��ӣ���Χ���ӣ��Ų�msnmpn��s�ܼ����ɵ�����Ϊ2����Y����ΪC��Si������QΪCԪ�أ�����YΪSiԪ�أ�R�ĺ���L��Ϊ����������R��2�����Ӳ㣬�����ΪLi��B��N��F��R��ԭ����������Q��X֮�䣬QΪCԪ�أ�XΪOԪ�أ���RΪNԪ�ء����Կ��Ƴ���QΪC��RΪN��XΪO��YΪSi��ZΪFe���ݴ˴��⡣
��1����RΪNԪ�أ�N3-��������Ų�ʽΪ��1S22S22P6���ʴ�Ϊ��1S22S22P6��
��2��ZΪFe��Fe (OH)3���ȵĻ�ѧ����ʽΪ��![]() ,�ʴ�Ϊ��
,�ʴ�Ϊ��![]() ��
��
��3��Q��Y���⻯��ֱ�ΪCH4��SiH4������C�ķǽ�����ǿ��Si�����ȶ���CH4��SiH4����ΪSiH4����Է���������CH4�ʷ��Ӽ��������е�ߣ��ʴ�Ϊ��b��
��4��QΪC��RΪN�� YΪSi��C��N��Si�У�C��Siλ��ͬһ���壬Si��ԭ�Ӱ뾶����C��C��Nλ��ͬһ���ڣ�C�İ뾶����N����ԭ�Ӱ뾶�Ӵ�С��˳��Ϊ��Si �� C �� N���ʴ�Ϊ��Si �� C �� N��
��5��C��H�γɵ���Է�������Ϊ26������ΪC2H2�������ʽΪ��H��C����C��H���ʴ�Ϊ��H��C����C��H��
��6��XΪO��YΪSi�����߹��ɵ�SiO2����������ԭ�ӣ��������ǹ��ۼ���������ԭ�Ӿ��壬�ʴ�Ϊ��ԭ�Ӿ��塣


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A. ʹ��̪���ɫ����Һ�У�Na����Al3����SO42����Cl��
B. ![]() =1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
=1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
C. ��Al��Ӧ�ܷų�H2����Һ�У�Fe2����K����NO3����SO42��
D. ˮ�����c(H��)=1��10��13mol��L��1����Һ�У�K����Na����AlO2����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶ȡ���ͬ�ݻ����ĸ��ܱ������н���ͬ���Ŀ��淴Ӧ��2X(g)+Y(g)![]() 3W(g)+2Z(g) ��H=��Q KJ/mol����ʼʱ������������ʵ�����ƽ��ʱ��ϵ�����仯�������������˵����ȷ���ǣ�������
3W(g)+2Z(g) ��H=��Q KJ/mol����ʼʱ������������ʵ�����ƽ��ʱ��ϵ�����仯�������������˵����ȷ���ǣ�������
X | Y | W | Z | ��Ӧ��ϵ�����仯 | |
�� | 2mol | 1mol | �ų�a kJ/mol | ||
�� | 1mol | 1mol | �ų�b kJ/mol | ||
�� | 2mol | 2mol | �ų�c kJ/mol | ||
�� | 3mol | 2mol | ����d kJ/mol |
A.X��ת����Ϊ���ף��ң���
B.c+d��Q
C.ƽ��ʱ���������еķ�Ӧ���ʱȶ������е���
D.ƽ��ʱ��������Z�����ʵ���Ũ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��SO2����ˮ��Ư���ԣ����������ʵ�飬װ����ͼ�����������գ�
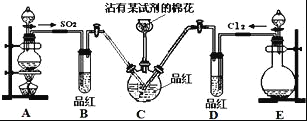
��1������մ�е��Լ���NaOH��Һ��������______��
��2���ٷ�Ӧ��ʼһ��ʱ���B��D�����Թ��п��Թ۲쵽������ֱ��ǣ�B��_____��D��____��
��ֹͣͨ���ֱ����B��D�����Թܣ����Թ۲쵽������ֱ��ǣ�B��_____��D��____��
��3����ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�������Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������룮�����������ԭ���û�ѧ����ʽ��ʾ��______��
��4��װ��E����_____���ѧʽ����Ũ���ᷴӦ�Ƶ�Cl2������2.24L����״������Cl2����������HClΪ____mol��
��5��ʵ���������պ���Լ���������SO42����ʵ�鷽���ǣ�ȡ���е�Һ���������μ�������ϡHNO3���ټ��뼸��BaCl2��Һ�����ְ�ɫ�������÷����Ƿ����____��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1934�������������Ӻ��![]() �õ�һ����Ȼ�粻���ڵĺ���
�õ�һ����Ȼ�粻���ڵĺ���![]() ��������������ص��Ⱥӡ��䷢���ı仯���£�
��������������ص��Ⱥӡ��䷢���ı仯���£�![]() +
+![]() ��
��![]() +
+![]() �������й�˵���������
�������й�˵���������
A.![]() ��
��![]() ����ԭ�ӻ�Ϊͬλ��
����ԭ�ӻ�Ϊͬλ��
B.��![]() ��������=������=���������
��������=������=���������
C.�ñ仯ͬ����ѭ�����غ㶨��
D.�ñ仯˵��ԭ�Ӻ��ڻ�ѧ��Ӧ��Ҳ�ܷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ�ӽṹ��˵������ȷ����
A.¬ɪ������![]() ����ɢ��������������Ѹ����ʽ����ԭ�ӽṹģ��
����ɢ��������������Ѹ����ʽ����ԭ�ӽṹģ��
B.ԭ���У��˶Ժ��������������ʵ���Ǻ��ڵ����ӶԺ�����ӵ�����
C.����������Ԫ�ص����࣬�������������ص�����
D.���е�ԭ�Ӷ��������ӡ����Ӻ͵���3�ֻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2CO3��NaHCO3����ʳ�ü���з���ʽ����ȷ���ǣ� ��
A.Na2O2��CO2��Ӧ����Na2CO3��Na2O2 +CO2=Na2CO3+O2
B.Na2CO3��Һ�ʼ��ԣ�CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.NaHCO3�������ͷۣ�2NaHCO3![]() Na2CO3+CO2�� +H2O
Na2CO3+CO2�� +H2O
D.Na2CO3��Һ��ȥCH3COOC2H5�е�CH3COOH��CO32-+2H+=CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.��ϡ������Һ�м�������ϡ��ˮ������������Ϊ���ܷ���ȡ����Ӧ
B.ʵ���ҽ���ʯ�͵�����������������ȡ����ϩ����ȡʵ��ʱ����Ҫʹ���¶ȼ�
C.�����ȵ�ͭ˿Ѹ�ٲ����Ҵ��У�������Σ��ɹ۲쵽ͭ˿�����ڣ������ŵ���ζ
D.��ǿ������ʢ��CH4��Cl2�������1��4���ļ���ƿ�ɹ۲쵽ƿ�ڱڸ�����״��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������п�����Ϊ2NO2(g) ![]() 2NO(g)+O2(g)�ﵽƽ��״̬�ı�־��( )
2NO(g)+O2(g)�ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2���ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO���ۻ���������ɫ���ٸı䣻�ܻ��������ܶȲ��ٸı��״̬���ݻ�������ƽ����Է����������ٸı��״̬�����������NO��O2�����ʵ���֮�ȱ��ֺ㶨�����������NO��NO2�����ʵ���֮�ȱ��ֺ㶨
A. �٢ۢݢ� B. �ڢܢ� C. �٢ۢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com