
����Ŀ��25 ��ʱ�й����ʵ���ɫ���ܶȻ���Ksp�����±���
���� | AgCl | AgBr | AgI | Ag2S |
��ɫ | �� | ���� | �� | �� |
Ksp | 1.8��10��10 | 7.7��10��13 | 1.5��10��16 | 1.8��10��50 |
���������в���ȷ���ǣ�������
A.��AgCl�İ�ɫ����Һ�м���0.1 mol/L KI��Һ���л�ɫ��������
B.25 ��ʱ�����ñ��е��ܶȻ���Ksp�������Լ���AgCl��AgBr��AgI��Ag2S����ˮ��Һ��Ag����Ũ��
C.25 �棬AgCl����ֱ��ڵ����ʵ���Ũ��NaCl��CaCl2��Һ���ܽ�ﵽƽ�⣬����Һ�У�c��Ag+�����ܶȻ�����ͬ
D.��5 mL 1.8��10��6 mol/L NaCl��Һ�У�����1�Σ�20��ԼΪ1 mL��1��10��3 mol/L AgNO3��Һ�����ܲ�����ɫ����
���𰸡�C
��������
A��������ͬ���͵��������Σ�һ��������ܶȻ���ij�������ת�����ܶȻ�С�ij���������AgCl�İ�ɫ����Һ�м���KI��Һ��������AgI��������A���������⣻
B��AgCl��AgBr��AgI��Ag2S����ˮ��Һ��Ag����Ũ�ȷֱ�Ϊ��![]() mol/L��
mol/L��![]() mol/L��
mol/L��![]() mol/L��
mol/L��![]() mol/L����B���������⣻
mol/L����B���������⣻
C�������ʵ���Ũ��NaCl��CaCl2��Һ��c(Cl-)��ͬ������ƽ���ƶ���֪��AgCl��������Һ���ܽ�Ȳ�ͬ�����¶Ȳ��䣬����ܶȻ���ͬ����c��Ag+����ͬ����C�������⣻
D��1����Һ���Ϊ0.05mL�����뵽5mL��Һ�У������Һ����������䣬���������������Һ��c(Ag+)=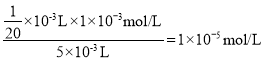 ��Qc(AgCl)=c(Ag+)c(Cl)=1.8��106molL1��1��105molL1=1.8��1011<1.8��1010�����Բ��ܲ�����ɫ��������D���������⣻
��Qc(AgCl)=c(Ag+)c(Cl)=1.8��106molL1��1��105molL1=1.8��1011<1.8��1010�����Բ��ܲ�����ɫ��������D���������⣻
�ʴ�Ϊ��C��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»����
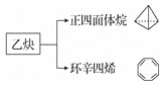
����˵����ȷ���ǣ� ��
A.����������ķ���ʽΪC4H8B.�������������ȡ��������1��
C.������ϩ�˴Ź���������2���D.������ϩ�뱽��Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯�ƣ�NaAlH4������Ҫ�Ļ�ԭ��������������Ҫ�ɷ�Al2O3��������SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ�NaAlH4��һ��������ͼ��
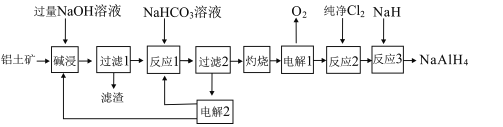
��֪�������SiO2ת�������ܵ�Na2Al2SixO8
��1��Na2Al2SixO8�����������ʽ��ʾΪ___��x�þ������ֵ��ʾ����
��2������1����Һ����Ҫ�ɷ�ΪNaOH��NaAlO2��д����Ӧ1��NaHCO3��NaAlO2��Ӧ�����ӷ���ʽ��___��
��3�����2����NaHCO3��NaOH����ѭ��ʹ�ã�д�����2�����ĵ缫��Ӧʽ��___��
��4����Ӧ3�Ļ�ѧ����ʽΪ___��
��5�����⻯����ˮ�������ҷ�Ӧ�����������ݣ��䷴Ӧ�Ļ�ѧ����ʽΪ___��
��6��������Ҫ�ɷ���Na2Al2SixO8��Fe2O3�����Բ�����ͼ���̽��з��룺

�����������������õĹ������ʿ���Ϊ___���ѧʽ����
��������������ġ�����ʡ����¶ȹ�ϵ��ͼ��ʾ���Խ����¶ȹ��ߣ�������ʡ����͵�ԭ��___��
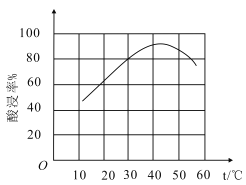
����֪�����£�Ksp[Fe(OH)3]��8.0��10-38��Al3+��ʼ������pHΪ4������Һ�����ӵ�Ũ��С��1��10-5mol/LΪ������ȫ��������Һ���ȷ����Fe3+��Ӧ����pH��ΧΪ___��lg2��0.3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�У���������������ԭ�����͵���
��Fe(SCN)3��Һ�м������KSCN����ɫ�������ϡ�����м�����������ˮ��������������Ũ�Ƚ��� ��ʵ���ҳ����ű���ʳ��ˮ�ķ����ռ����� ���غ�ɫNO2��ѹ����ɫ�ȱ�����dz �ݼ�����������ںϳɰ��ķ�Ӧ ����H2(g)��I2(g)��HI(g)��ɵ�ƽ����ϵ��ѹ����ɫ���� ��500��ʱ�����¸������ںϳɰ��ķ�Ӧ �ཫ��������еİ�Һ�������ںϳɰ���Ӧ
A. �٢ڢޢ�B. �٢ۢݢ�C. �ڢݢޢ�D. �ڢۢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Է�ĩ״���ڣ��Ͱ�������������ͬ�������塣��֪��
��Sn��s���ף�+2HCl��aq��=SnCl2��aq��+H2��g�� ��H1
��Sn��s���ң�+2HCl��aq��=SnCl2��aq��+H2��g�� ��H2
��Sn��s���ң�![]() Sn��s���ף� ��H3=+2.1kJmol-1
Sn��s���ף� ��H3=+2.1kJmol-1
����˵����ȷ���ǣ� ��
A.��H1>��H2
B.���ڳ������Ի���״̬����
C.����תΪ�����ķ�Ӧ�Ƿ��ȷ�Ӧ
D.���������ڴ��ڵ���13.2��Ļ����У������лٻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ��������ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H=-92.4 kJ/mol���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3��g����H=-92.4 kJ/mol���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/K | 298 | 398 | 498 | ...... |
K/��mol/L��2 | 4.1��106 | K1 | K2 | ...... |
����������⣺
�ٱȽ�K1��K2�Ĵ�С��K1_______K2������>������=������<������
���ں��º�ѹ���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______������ţ���
A 2v��H2��������=3v��NH3�����棩
B 2v��N2��������=v��H2�����棩
C ������ѹǿ���ֲ���
D ���������ܶȱ��ֲ���
��2����ҵ���������صĻ�ѧ����ʽΪ��2NH3��g��+CO2��g��![]() CO��NH2��2��s��+H2O��l������T�棬���Ϊ4L���ܱ������У�ͨ��6molNH3��3molCO2����Ӧ�ﵽƽ��ʱ��c��NH3��=0.5mol��L��1����÷�Ӧ��ƽ�ⳣ��K=_______������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3molNH3�����ʱ��Ӧ��v��_______v��������>����<������=������
CO��NH2��2��s��+H2O��l������T�棬���Ϊ4L���ܱ������У�ͨ��6molNH3��3molCO2����Ӧ�ﵽƽ��ʱ��c��NH3��=0.5mol��L��1����÷�Ӧ��ƽ�ⳣ��K=_______������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3molNH3�����ʱ��Ӧ��v��_______v��������>����<������=������
��3����ǿ���Եĵ����ˮ��Һ�У����Բ������缫�����CO2�ɵõ�����ȼ�ϣ���ԭ����ͼ��ʾ��
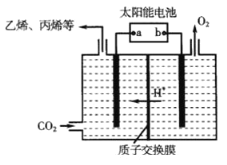
�ٸù���������ת����ʽ��Ҫ��_______��
�ڵ��ʱ��������ϩ�ĵ缫��Ӧʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ���ᡢ�����͡���˾ƥ�ֵĽṹ��ʽ���£�����˵������ȷ����

A. ��ˮ�����ƶ����͵ķ�Ӧ��ȡ����Ӧ
B. �����ͱ����ϵ�һ��ȡ������4��
C. ����FeCl3��Һ���鰢˾ƥ�����Ƿ����ˮ����
D. ��ͬ���ʵ����Ķ����ͺͰ�˾ƥ������NaOH�����ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����![]()
![]()
A.Na2S��Һ��S2-��ˮ�⣺![]()
B.��ʯī���缫���NaCl��Һ��![]()
C.��������ȼ�ϵ�ظ�����ӦΪ: H2 +2OH-2e- = 2H2O
D.��������������ʴ��������ӦΪ��Fe-3e- = Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������((ClNO)�Ǻϳ��л������Ҫ�м��壬ijѧϰС����ʵ������Cl2��NO�Ʊ�ClNO���ⶨ�䴿�ȣ����ʵ��װ����ͼ��ʾ��
��֪��1�����������ȷе�Ϊ��5.5�棬��ˮ�⣬C1NO+H2O=HNO2+HCl��
2����AgNO2����ˮ�����������ᣬAgNO2+HNO3=AgNO3+HNO2��
��1���Ʊ�Cl2�ķ���װ�ÿ���ѡ��__(����ĸ����)װ�ã�������Ӧ�����ӷ���ʽΪ__��
��2�����ռ�һƿ���﴿����������ѡ����ʵ�װ�ã�������˳��Ϊa��__(������������Сд��ĸ��ʾ)��
��3��ʵ���ҿ���ͼʾװ���Ʊ��������ȣ�
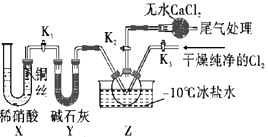
��ʵ������Xװ���Ʊ�NO����Ҫ���ŵ�Ϊ__��װ������ˮCaCl2��������__��
��4��ͨ������ʵ��ⶨC1NO��Ʒ�Ĵ��ȡ�ȡZ������Һ��mg����ˮ�����Ƴ�250mL��Һ��ȡ��25.00mL��Ʒ������ƿ�У���K2CrO4��ҺΪָʾ������cmol��L-1AgNO3����Һ�ζ����յ㣬���ı���Һ�����Ϊ20.00mL���ζ��յ��������__����������(ClNO)����������Ϊ__��(��֪��Ag2CrO4Ϊש��ɫ���壻Ksp(AgCl)=1.56��10-10��Ksp(Ag2CrO4)=1��10-2)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com