
【题目】下列指定反应的离子方程式正确的是![]()
![]()
A.Na2S溶液中S2-的水解:![]()
B.用石墨作电极电解NaCl溶液:![]()
C.碱性氢氧燃料电池负极反应为: H2 +2OH-2e- = 2H2O
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e- = Fe3+
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
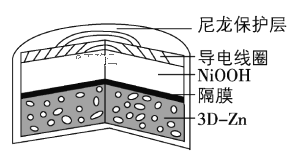
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e= Zn(s)+2OH(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e =Ni(OH)2(s)+OH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)-空气电池工作时反应为:4VB2 +11O2![]() 4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是
4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是

A. VB2电极发生的电极反应为: 2VB2+11H2O – 22e![]() V2O5+2B2O3+22H+
V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为200mL,则CuSO4溶液的浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(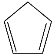 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)
(g) ![]()
![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g)
(g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) ![]() 2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:
2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:![]() (g)+ I2(g)
(g)+ I2(g) ![]()
![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质![]() 的原理如图所示。下列说法不正确的是( )
的原理如图所示。下列说法不正确的是( )
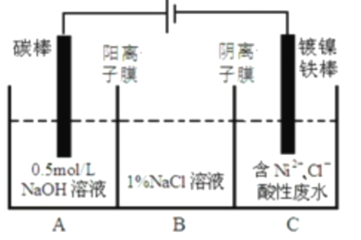
已知:①![]() 在弱酸性溶液中发生水解;②氧化性:
在弱酸性溶液中发生水解;②氧化性:![]() (高浓度)
(高浓度)![]() (低浓度)。
(低浓度)。
A.电解过程中,B中![]() 溶液的物质的量浓度将不断增大
溶液的物质的量浓度将不断增大
B.碳棒上发生的电极反应:![]()
C.为了提高![]() 的产率,电解过程中需要控制废水的
的产率,电解过程中需要控制废水的![]()
D.该装置中电子的流向:电源负极→阴极→阳极→电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷![]() 和三氯氧磷
和三氯氧磷![]() ,是两种重要的化工原料。
,是两种重要的化工原料。
(1)实验室制备![]() 的装置图(如图)和有关信息如下:
的装置图(如图)和有关信息如下:

物质 | 熔点/℃ | 沸点/℃ | 密度 | 性质 |
白磷 | 44.1 | 280.5 | 1.82 | 湿空气中约40℃着火 |
|
| 74.2 | 1.574 | 无色液体,遇水均剧烈水解,互溶 |
| 2.0 | 105.3 | 1.675 |
①实验开始先打开![]() 通入
通入![]() 排除装置内空气的目的是______________________。
排除装置内空气的目的是______________________。
②实验制得的粗产品中含有![]() ,可用_______方法提纯。
,可用_______方法提纯。
③![]()
![]() 和
和![]() ,水解后的溶液中除
,水解后的溶液中除![]() 之外其他离子的浓度由大到小的顺序是___________________________________(已知
之外其他离子的浓度由大到小的顺序是___________________________________(已知![]() 是二元弱酸)。
是二元弱酸)。
(2)实验室通常用![]() 直接氧化
直接氧化![]() 制备
制备![]() ,工业上通常采用潮湿的
,工业上通常采用潮湿的![]() 氧化
氧化![]() 制备
制备![]() ,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
(3)用![]() 标准溶液定量测定实验室制备的
标准溶液定量测定实验室制备的![]() 粗产品的纯度,实验步骤如下:
粗产品的纯度,实验步骤如下:
①取![]() 粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入
粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入![]() 溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的
溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的![]() 纯度___________(填“偏大”“偏小”或“不变”)。[已知:
纯度___________(填“偏大”“偏小”或“不变”)。[已知:![]() ]
]
②滴加![]() 作指示剂,用
作指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 溶液,当溶液__________________________,即为终点。共用去
溶液,当溶液__________________________,即为终点。共用去![]() 溶液,则粗产品中
溶液,则粗产品中![]() 的纯度为_________%(保留小数点后1位)。
的纯度为_________%(保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
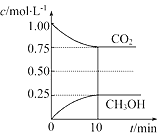
(1)能说明该反应已达平衡状态的是________(填编号)。
A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)若要使K=1,则改变的条件可以是________(填选项)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是 __________________;
②确定分子式:如图是该有机物的质谱图,则其相对分子质量为 ____;分子式为 _____;

③结构式的确定:经测定,该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6∶1∶2∶1;该有机物与金属钠反应产生氢气;则A的结构简式为 _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com