
【题目】环戊二烯(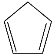 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)
(g) ![]()
![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g)
(g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) ![]() 2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:
2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:![]() (g)+ I2(g)
(g)+ I2(g) ![]()
![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
【答案】89.3 40% 3.56×104 BD CD
【解析】
(1)利用盖斯定律解题;
(2)利用差量法计算转化率;三行式法计算平衡常数;根据平衡移动原理解释;
(3)通过外界因素对速率的影响和平衡状态的形成分析A、B、C选项,D选项观察图象计算;
(1)已知:![]() (g)=
(g)=![]() (g)+H2(g)△H1=+100.3kJmol-1 ①,H2(g)+I2(g)=2HI(g)△H2=-11.0kJmol-1②,根据盖斯定律,①+②得③
(g)+H2(g)△H1=+100.3kJmol-1 ①,H2(g)+I2(g)=2HI(g)△H2=-11.0kJmol-1②,根据盖斯定律,①+②得③![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)△H3=(+100.3kJmol-1)+(-11.0kJmol-1)=+89.3kJmol-1;
(g)+2HI(g)△H3=(+100.3kJmol-1)+(-11.0kJmol-1)=+89.3kJmol-1;
(2)设碘和环戊烯(![]() )的初始物质的量都为nmol,转化的物质的量为xmol,
)的初始物质的量都为nmol,转化的物质的量为xmol,
![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)
(g)+2HI(g)
初始(mol) n n 0 0
转化(mol)x x x 2x
平衡(mol)n-x n-x x 2x
刚性容器内气体的压强与物质的量成正比,则:![]() =1+20%,解得:x=0.4n,
=1+20%,解得:x=0.4n,
平衡时环戊烯的转化率为:![]() ×100%=40%;
×100%=40%;
平衡时混合气体的压强为:105Pa×(1+20%)=1.2×105Pa,混合气体总物质的量为:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,
平衡时各组分所占压强分别为p(![]() )=p(I2)=
)=p(I2)=![]() ×1.2×105Pa=3×104Pa,p(
×1.2×105Pa=3×104Pa,p(![]() )=
)=![]() ×1.2×105Pa=2×104Pa,p(HI)=
×1.2×105Pa=2×104Pa,p(HI)=![]() ×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=
×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=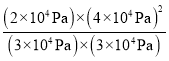 ≈3.56×104Pa;
≈3.56×104Pa;
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
故答案为BD;
(3)A.温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A错误;
B.根据图象可知,a点切线斜率的绝对值大于c点切线的绝对值,则a点速率大于c点,故B错误;
C.a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆),则a点的正反应速率大于b点的逆反应速率,故C正确;
D.b点时环戊二烯的浓度变化为:1.5mol/L-0.6mol/L=0.9mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的![]() ,则b点时二聚体的浓度为0.9mol/L×
,则b点时二聚体的浓度为0.9mol/L×![]() =0.45molL-1,故D正确;
=0.45molL-1,故D正确;
故答案为CD。


科目:高中化学 来源: 题型:
【题目】许多无机颜料在缤纷的世界扮演了重要角色。如历史悠久的铅白[2PbCO3Pb(OH)2]安全环保的钛白(TiO2),鲜艳的朱砂(HgS),稳定的铁红(Fe2O3)等。下列解释错误的是( )
A.《周易参同契》中提到“胡粉(含铅白)投火中,色坏还原为铅”,其中含铅元素的物质转化为2PbCO3·Pb(OH)2→PbO2→Pb
B.纳米级的钛白可由TiCl4水解制得:TiCl4+2H2OTiO2+4HCl
C.《本草经疏》中记载朱砂“若经伏火及一切烹、炼,则毒等砒、硇服之必毙”,体现了HgS受热易分解的性质
D.铁红可由无水FeSO4高温煅烧制得:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸、冬青油、阿司匹林的结构简式如下,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 冬青油苯环上的一氯取代物有4种
C. 可用FeCl3溶液检验阿司匹林中是否混有水杨酸
D. 相同物质的量的冬青油和阿司匹林消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
![]()
A.Na2S溶液中S2-的水解:![]()
B.用石墨作电极电解NaCl溶液:![]()
C.碱性氢氧燃料电池负极反应为: H2 +2OH-2e- = 2H2O
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e- = Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应: A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量
⑤混合气体的平均相对分子质量 ⑥混合气体的总质量 ⑦C、D的浓度之比等于化学计量数之比
A.全部B.①③④⑤C.②③④⑤D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是
A.  3﹣甲基﹣2﹣乙基戊烷
3﹣甲基﹣2﹣乙基戊烷
B. (CH3)3CCH2CH(C2H5)CH32,2﹣二甲基﹣4﹣乙基戊烷
C. ![]() 邻甲基苯酚
邻甲基苯酚
D. ![]() 2﹣甲基﹣3﹣戊炔
2﹣甲基﹣3﹣戊炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com