
【题目】许多无机颜料在缤纷的世界扮演了重要角色。如历史悠久的铅白[2PbCO3Pb(OH)2]安全环保的钛白(TiO2),鲜艳的朱砂(HgS),稳定的铁红(Fe2O3)等。下列解释错误的是( )
A.《周易参同契》中提到“胡粉(含铅白)投火中,色坏还原为铅”,其中含铅元素的物质转化为2PbCO3·Pb(OH)2→PbO2→Pb
B.纳米级的钛白可由TiCl4水解制得:TiCl4+2H2OTiO2+4HCl
C.《本草经疏》中记载朱砂“若经伏火及一切烹、炼,则毒等砒、硇服之必毙”,体现了HgS受热易分解的性质
D.铁红可由无水FeSO4高温煅烧制得:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的四种物质,且A、B、C中含有同一种元素,其转化关系如图所示。下列说法正确的是( )
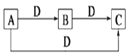
A. 若B为一种两性氢氧化物,则D可能是强酸,也可能是强碱
B. 若A为固态非金属单质,D为O2,则A可以为单质硫
C. 若A为强碱,D为CO2,则B的溶解度一定大于C的溶解度
D. 若A为18电子气态氢化物,D为O2,则A只能是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在___(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用__(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视___。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__mol·L-1,烧碱样品的纯度是___(保留两位数字)。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果___。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
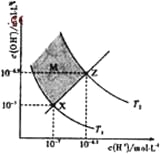
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
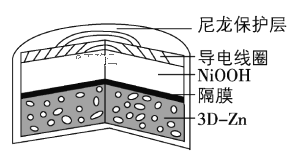
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e= Zn(s)+2OH(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e =Ni(OH)2(s)+OH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分含铁元素的微粒在溶液中的物质的量分数与溶液pH的关系如图所示。下列说法错误的是( )

A.pH=4时,溶液中存在下列关系c(HFeO4-)>c(H2FeO4)>c(FeO42-)
B.H2FeO4的第一步电离平衡常数Ka1=4.15×10-4
C.B点溶液加NaOH溶液到pH为4的过程中,![]() 减小
减小
D.B、C两点对应溶液中水的电离程度:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(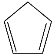 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)
(g) ![]()
![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g)
(g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) ![]() 2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:
2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:![]() (g)+ I2(g)
(g)+ I2(g) ![]()
![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com