
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
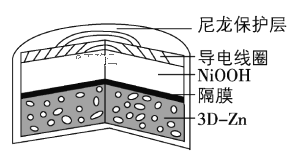
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e= Zn(s)+2OH(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e =Ni(OH)2(s)+OH(aq)
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布图为________。
(2)第四周期中,与溴原子未成对电子数相同的金属元素有________种。
(3)某同学画出基态碳原子的核外电子排布图为![]() ,该电子排布图违背了________。
,该电子排布图违背了________。
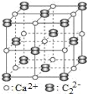
(4)CaC2 中C22-与O22+互为等电子体。
①O22+的电子式可表示为______。
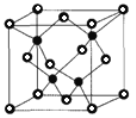
②CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长。则CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如图甲所示:己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度(g/cm3)为________(写出计算式即可)。
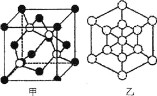
②图甲中![]() 表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用
表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用![]() 画出P原子的投影位置。__________________________
画出P原子的投影位置。__________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
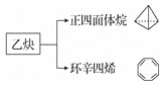
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
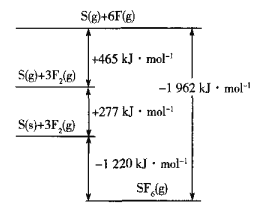
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多无机颜料在缤纷的世界扮演了重要角色。如历史悠久的铅白[2PbCO3Pb(OH)2]安全环保的钛白(TiO2),鲜艳的朱砂(HgS),稳定的铁红(Fe2O3)等。下列解释错误的是( )
A.《周易参同契》中提到“胡粉(含铅白)投火中,色坏还原为铅”,其中含铅元素的物质转化为2PbCO3·Pb(OH)2→PbO2→Pb
B.纳米级的钛白可由TiCl4水解制得:TiCl4+2H2OTiO2+4HCl
C.《本草经疏》中记载朱砂“若经伏火及一切烹、炼,则毒等砒、硇服之必毙”,体现了HgS受热易分解的性质
D.铁红可由无水FeSO4高温煅烧制得:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究铁离子与硫离子的反应,实验操作及现象如表:下列有关说法错误的( )
| 滴入FeCl3溶液立刻有黑色沉淀生成继续滴入FeC13溶液,黑色沉淀增多后又逐渐转化为黄色沉淀 |
| 滴入Na2S溶液立刻生成黑色沉淀,沉淀下沉逐渐转化为黄色。继续滴入Na2S溶液,最后出现黑色的沉淀 |
A.两次实验中,开始产生的黑色沉淀都为Fe2S3
B.两次实验中,产生的黄色沉淀是因为发生了反应Fe2S3+4FeCl3═6FeCl2+3S
C.向稀FeCl3溶液中逐滴加入稀Na2S溶液至过量最后生成的黑色沉淀为FeS
D.在Na2S溶液过量的情况下,黑色沉淀中存在较多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是重要的还原剂。以铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3等杂质)为原料制备NaAlH4的一种流程如图:
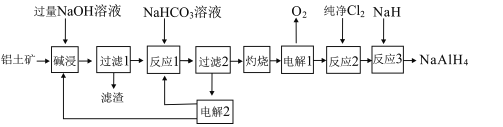
已知:碱浸中SiO2转化成难溶的Na2Al2SixO8
(1)Na2Al2SixO8用氧化物的形式表示为___(x用具体的数值表示)。
(2)过滤1得滤液的主要成分为NaOH和NaAlO2,写出反应1中NaHCO3与NaAlO2反应的离子方程式:___。
(3)电解2生成NaHCO3和NaOH用于循环使用,写出电解2阴极的电极反应式:___。
(4)反应3的化学方程式为___。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为___。
(6)滤渣主要成分有Na2Al2SixO8和Fe2O3,可以采用如图流程进行分离:

①滤渣溶于盐酸所得的固体物质可能为___(填化学式)。
②滤渣溶于盐酸的“酸浸率”与温度关系如图所示,试解释温度过高,“酸浸率”降低的原因___。
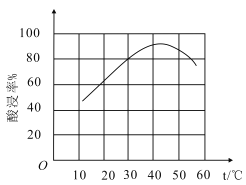
③已知常温下,Ksp[Fe(OH)3]=8.0×10-38,Al3+开始沉淀的pH为4,(溶液中离子的浓度小于1×10-5mol/L为沉淀完全),从滤液中先分离出Fe3+,应调节pH范围为___(lg2≈0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
![]()
A.Na2S溶液中S2-的水解:![]()
B.用石墨作电极电解NaCl溶液:![]()
C.碱性氢氧燃料电池负极反应为: H2 +2OH-2e- = 2H2O
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e- = Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com