
【题目】工业上用电解法处理含镍酸性废水并得到单质![]() 的原理如图所示。下列说法不正确的是( )
的原理如图所示。下列说法不正确的是( )
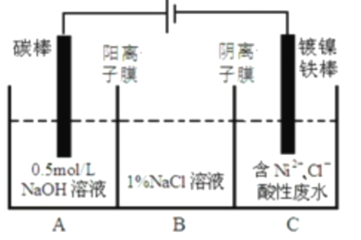
已知:①![]() 在弱酸性溶液中发生水解;②氧化性:
在弱酸性溶液中发生水解;②氧化性:![]() (高浓度)
(高浓度)![]() (低浓度)。
(低浓度)。
A.电解过程中,B中![]() 溶液的物质的量浓度将不断增大
溶液的物质的量浓度将不断增大
B.碳棒上发生的电极反应:![]()
C.为了提高![]() 的产率,电解过程中需要控制废水的
的产率,电解过程中需要控制废水的![]()
D.该装置中电子的流向:电源负极→阴极→阳极→电源正极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组同学探究铁离子与硫离子的反应,实验操作及现象如表:下列有关说法错误的( )
| 滴入FeCl3溶液立刻有黑色沉淀生成继续滴入FeC13溶液,黑色沉淀增多后又逐渐转化为黄色沉淀 |
| 滴入Na2S溶液立刻生成黑色沉淀,沉淀下沉逐渐转化为黄色。继续滴入Na2S溶液,最后出现黑色的沉淀 |
A.两次实验中,开始产生的黑色沉淀都为Fe2S3
B.两次实验中,产生的黄色沉淀是因为发生了反应Fe2S3+4FeCl3═6FeCl2+3S
C.向稀FeCl3溶液中逐滴加入稀Na2S溶液至过量最后生成的黑色沉淀为FeS
D.在Na2S溶液过量的情况下,黑色沉淀中存在较多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
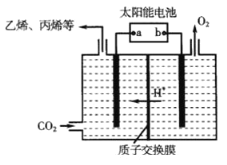
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应 ①自发进行的条件是________________,ΔH3 =_____________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
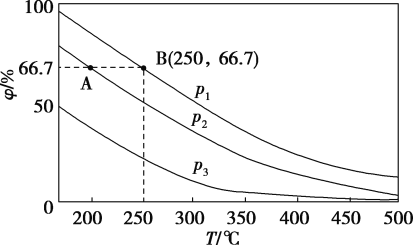
①其中,p1、p2和p3由大到小的顺序是________,其原因是_________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
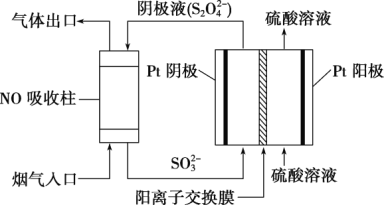
①阴极区的电极反应式为_____________________________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
![]()
A.Na2S溶液中S2-的水解:![]()
B.用石墨作电极电解NaCl溶液:![]()
C.碱性氢氧燃料电池负极反应为: H2 +2OH-2e- = 2H2O
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e- = Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 和
和![]() 在工业生产中有重要的应用。
在工业生产中有重要的应用。
(1)用![]() 处理废气中的
处理废气中的![]() 会生成
会生成![]() 、
、![]() 两种单质。在该反应中,氧化剂与还原剂的物质的量之比为_________________________。
两种单质。在该反应中,氧化剂与还原剂的物质的量之比为_________________________。
(2)利用![]() 可消除
可消除![]() 污染,其反应为
污染,其反应为![]() ,不同温度下,向装有足量
,不同温度下,向装有足量![]() 固体的
固体的![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() ,测得
,测得![]() 气体的体积分数
气体的体积分数![]() 随时间
随时间![]() 的变化曲线如图所示。
的变化曲线如图所示。

①温度为T2时,![]() 内,
内,![]() 的平均反应速率
的平均反应速率![]() _____________________。
_____________________。
②该反应的![]() ________0(填“>”“<”或“=”),判断的理由是_________________。
________0(填“>”“<”或“=”),判断的理由是_________________。
(3)常温下,已知![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() ,通过计算可得
,通过计算可得![]() 的
的![]() 溶液
溶液![]() ___________。
___________。
(4)为了确定![]() 氧化速率方程式
氧化速率方程式![]() 中
中![]() 的值(取整数),进行了相应实验。当溶解
的值(取整数),进行了相应实验。当溶解![]() 的浓度为
的浓度为![]() 时,
时,![]() 与速率(
与速率(![]() )数值的关系如下表所示,则
)数值的关系如下表所示,则![]() _______。
_______。
| 3.65 | 7.30 | 10.95 | 14.60 |
| 10.2 | 40.80 | 91.80 | 163.20 |
(5)某工业废水中含有![]() 、
、![]() 等离子。取一定量的该工业废水,向其中滴加
等离子。取一定量的该工业废水,向其中滴加![]() 溶液,当
溶液,当![]() 开始沉淀时,溶液中
开始沉淀时,溶液中 _______(保留两位有效数字)。(已知:25℃时,
_______(保留两位有效数字)。(已知:25℃时, ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)作为著名的铁电和压电材料,因其优异电性能和低污染性受到人们重视,也是目前制备无铅压电陶瓷的重要候选材料。某工厂以重晶石(主要含BaSO4)为原料,生产钛酸钡的工艺流程如图:

回答下列问题:
(1)酸浸时将BaCO3研成粉末并适当增大盐酸浓度,是为了___;常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是__。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=__(填写计算结果);若不考虑CO32-的水解,要使2.33gBaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液__mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
(3)流程中“滤液"的主要成分为__;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和混合气态产物,试写出反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。
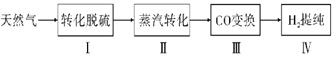
请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如下。
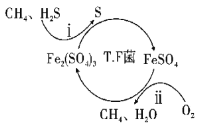
(1)过程i的离子反应方程式为__。
(2)已知:
①Fe3+在pH=1.9时开始沉淀pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
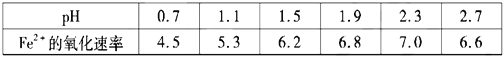
下列说法正确的是___
A.在转化脱硫中,最佳的pH范围是1.5<pH<1.9
B.在转化脱硫中需要不断补充Fe2(SO4)3
C.在转化脱硫中是O2间接地把H2S氧化为S
D.在转化脱硫中CH4作为还原剂被氧化
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。

(3)①该过程的热化学方程式是__。
②比较压强p1和p2的大小关系:p1__p2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程示意图如图。
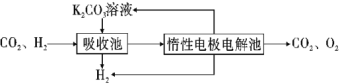
(4)吸收池中发生反应的离子方程式是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com