
����Ŀ��������Ϊ�����Դ���Ź㷺��Ӧ��ǰ����������Ȼ���Ʊ�������������ͼ��
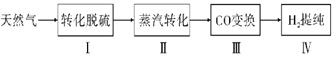
��ش��������⣺
I.ת��������Ȼ��ѹ����������30��ʱ����T��F�������£����Ի������������ʾ��ͼ���¡�
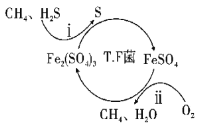
��1������i�����ӷ�Ӧ����ʽΪ__��
��2����֪��
��Fe3+��pH=1.9ʱ��ʼ����pH=3.2ʱ������ȫ��
��30��ʱ����T��F�������£���ͬpH��FeSO4��Һ��Fe2+���������������
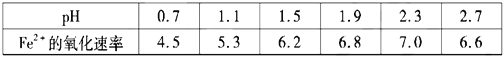
����˵����ȷ����___
A����ת�������У���ѵ�pH��Χ��1.5<pH<1.9
B����ת����������Ҫ���ϲ���Fe2(SO4)3
C����ת����������O2��ӵذ�H2S����ΪS
D����ת��������CH4��Ϊ��ԭ��������
��.����ת�����ڴ����������£�ˮ������CH4�����������ͼ�ش����⡣

��3���ٸù��̵��Ȼ�ѧ����ʽ��__��
�ڱȽ�ѹǿp1��p2�Ĵ�С��ϵ��p1__p2(ѡ����<������>������=��)��
��.CO�任��500��ʱ��CO��һ����ˮ��Ӧ����CO2��H2��
��.�ᴿ����CO2��H2����õ�H2�Ĺ���ʾ��ͼ��ͼ��
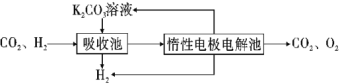
��4�����ճ��з�����Ӧ�����ӷ���ʽ��__��
���𰸡�2Fe3++H2S=2Fe2++S��+2H+ AC CH4(g)+H2O(g)=CO(g)+3H2(g) ��H=+204kJ/mol > CO2+H2O+CO32-=2HCO3-
��������
I��(1)���ⱻ�������������ɵ�����
(2)��ͼ������֪��1.5��pH��1.9����pH����1.9ʱ��Fe3+��ʼ����������Fe3+��Fe2+����Ũ�Ⱦ��½������ͷ�Ӧ���ʣ�pH��1.5ʱ��TF�����Խϵͣ�Fe2(SO4)3��ѭ�����ã�������Ӧ��ʵ�ʣ�O2��ӵذ�H2S����ΪS������ˮ��������CH4δ���뷴Ӧ��
����(3)���ڴ����������£�ˮ������CH4��������һ����̼��ˮ������ͼ�з�Ӧ���ʱ��H=2582KJ/mol-2378KJ/mol=204KJ/mol����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ�д���Ȼ�ѧ����ʽ��
��ͼ���м������������ѹǿ�������ݴ˷�����
����(4)������̼��̼�����Һ��Ӧ����̼����ء�
I�� (1)���ⱻ�������������ɵ�������i��H2S������������Ӧ�����ӷ���ʽ��2Fe3++H2S=2Fe2++S��+2H+���ʴ�Ϊ��2Fe3++H2S=2Fe2++S��+2H+��
(2) A. Fe3+��pH=l.9ʱ��ʼ������pH=3.2ʱ������ȫ������30��ʱ����T��F�������£���ͬpH��FeSO4��Һ��Fe2+���������ʿ�֪����ҵ����Ӧѡ������pH��Χ1.5��PH��1.9����PH����1.9ʱ��Fe3+��ʼ����������Fe3+��Fe2+����Ũ�Ⱦ��½������ͷ�Ӧ���ʣ�PH��1.5ʱ��TF�����Խϵͣ���Ӧ���ʼ�����A����ȷ��B. Fe2(SO4)3��ѭ�����ã�����Ҫ����Fe2(SO4)3��B�����C. ������Ӧ��ʵ�ʣ�O2��ӵذ�H2S����ΪS������ˮ�� C����ȷ��D. ������CH4δ���뷴Ӧ��D����ʴ�ѡAC��
(3)���ڴ����������£�ˮ������CH4��������һ����̼��ˮ������ͼ�з�Ӧ���ʱ��H=2582KJ/mol-2378KJ/mol=204KJ/mol����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ�д���Ȼ�ѧ����ʽΪ��CH4(g)+H2O(g)=CO(g)+3H2(g)��H=+204KJ/mol���ʴ�Ϊ��CH4(g)+H2O(g)=CO(g)+3H2(g)��H=+204KJ/mol��
�ڷ�Ӧǰ���������ʵ�����������ѹǿƽ��������У�ͼ���м������������ѹǿ��������ݴ˷������Ƚ�ѹǿP1��P2�Ĵ�С��ϵ��P1��P2���ʴ�Ϊ>��
����(4)�ٽ�CO2��H2����õ�H2�Ĺ���ʾ��ͼ�����õ���������̼��̼�����Һ��Ӧ����̼����أ���Ӧ�����ӷ���ʽΪCO2+H2O+CO32-=2HCO3-���ʴ�Ϊ��CO2+H2O+CO32-=2HCO3-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
CH3CH2CH2+HCl![]() CH3CH2CH3 +Cl
CH3CH2CH3 +Cl![]() CH(CH3)2 + HCl
CH(CH3)2 + HCl
CH3CH2CH2+ HBr![]() CH3CH2CH3+Br
CH3CH2CH3+Br![]() CH(CH3)2+HBr
CH(CH3)2+HBr
����˵����ȷ���ǣ� ��
A.��H1=��H2+��H3-��H4
B.HCl��HBr�ļ��ܲ���Ա�ʾΪ��H1-��H3
C.��H2>��H4
D.����ʱ��������Cl��Ӧ���ʼӿ죬��Br��Ӧ���ʽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���õ�ⷨ�����������Է�ˮ���õ�����![]() ��ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
��ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
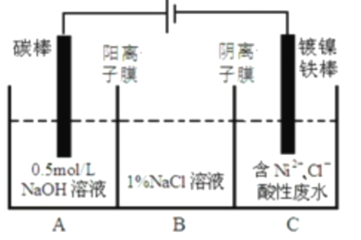
��֪����![]() ����������Һ�з���ˮ�⣻�������ԣ�
����������Һ�з���ˮ�⣻�������ԣ�![]() ����Ũ�ȣ�
����Ũ�ȣ�![]() ����Ũ�ȣ���
����Ũ�ȣ���
A.�������У�B��![]() ��Һ�����ʵ���Ũ�Ƚ���������
��Һ�����ʵ���Ũ�Ƚ���������
B.̼���Ϸ����ĵ缫��Ӧ��![]()
C.Ϊ�����![]() �IJ��ʣ�����������Ҫ���Ʒ�ˮ��
�IJ��ʣ�����������Ҫ���Ʒ�ˮ��![]()
D.��װ���е��ӵ�����Դ��������������������Դ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H3BO3)Ϊ���ᣬ��֪H3BO3������NaOH��Һ��Ӧ�����ӷ���ʽΪH3BO3+OH-=B(OH)4-��H3BO3����ͨ�����ķ����Ʊ����乤��ԭ����ͼ��ʾ(��Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ��)������˵��������ǣ� ��
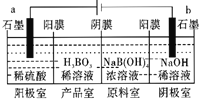
A.�����ĵ缫��ӦʽΪ��2H2O-4e-=O2��+4H+
B.��Ӧһ��ʱ���Ժ�������NaOH��ҺŨ������������H2SO4Ũ������
C.����·��ͨ��3mol����ʱ���ɵõ�1molH3BO3
D.�������У�B(OH)4-������Ĥ�����Ʒ�ϣ�Na+������Ĥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2mol CO2��3mol H2�������ķ�ӦΪCO2(g)+3H2(g)CH3OH(g)+H2O(g) ��H=��akJmol��1(a��0)�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
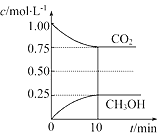
(1)��˵���÷�Ӧ�Ѵ�ƽ��״̬����________(����)��
A.��λʱ����ÿ����1.2mol H2��ͬʱ����0.4mol H2O
B.CO2����������ڻ�������б��ֲ���
C.��������ƽ����Է�����������ʱ��ı仯���仯
D.����ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ���
(2)��ҪʹK=1����ı������������________(��ѡ��)��
A.����ѹǿ B.��Сѹǿ C.�����¶� D.�����¶� E.���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NO2��SO2��CO���к�����Դ���������Σ����������Ĺ�ͬ��
��1����ԭ�Ӿ���ѧԭ�������£���ѧ����CO��H2�ڼ��ȼ�ѹ�����ϳ���Һ��ȼ�ϼ״����仯ѧ��Ӧ����ʽΪ__��
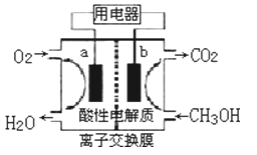
��2���Լ״���ȼ�ϵĵ�أ���ͼ��ʾ���为����__����a��b���������ķ�ӦʽΪ___�������ķ�ӦʽΪ___����ȼ�ϵ��������״̬�£�����96.5%�Ļ�ѧ��ת���ɵ��ܣ�������1molҺ��״����ܲ����������ܴ�702.1kJ����ͨ���״�ȼ�յ��Ȼ�ѧ��Ӧ����ʽΪ__��
��3����֪��NO2��g��+SO2��g��SO3��g��+NO��g�� ��H=+41.8kJmol��1��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����___��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1molSO3��ͬʱ����1molNO2
��������Ӧƽ��ʱ�����NO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=__�������Ѵ�ƽ��״̬��������Ӧ����ʱ��ƽ�ⳣ��K��__�������С�䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������·�Ӧ�õ�
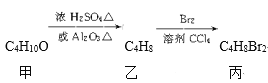
���Ľṹ��ʽ�������ǣ� ��
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C6H14�ĸ���ͬ���칹������������������һ��ȡ�������Ŀ�ֱ��ǣ� ��
A.2������������4��һ�ȴ��� B.4������������1��һ�ȴ���
C.3������������5��һ�ȴ��� D.4������������4��һ�ȴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NaOH��Һ�ζ�H2C2O4��Һ����Һ��-lg[c(H+)/c(H2C2O4)]��-lgc(HC2O4-)��-lg[c(H+)/c(HC2O4-)]��-lgc(C2O42-)��ϵ��ͼ��ʾ������˵���������( )
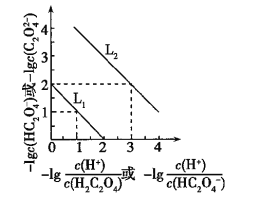
A. Ka1(H2C2O4)=1��10��2
B. �ζ�������,��pH=5ʱ��C(Na��)��3C(HC2O4-)>0
C. ��1 mol/L��H2C2O4��Һ�м���������Ũ�ȵ�NaOH��Һ����ȫ��Ӧ��������
D. ��0.1 mol/L��H2C2O4��Һ�м�ˮϡ�ͣ�C(HC2O4-)/C(H2C2O4)��ֵ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com