
【题目】已知:
CH3CH2CH2+HCl![]() CH3CH2CH3 +Cl
CH3CH2CH3 +Cl![]() CH(CH3)2 + HCl
CH(CH3)2 + HCl
CH3CH2CH2+ HBr![]() CH3CH2CH3+Br
CH3CH2CH3+Br![]() CH(CH3)2+HBr
CH(CH3)2+HBr
下列说法正确的是( )
A.ΔH1=ΔH2+ΔH3-ΔH4
B.HCl和HBr的键能差可以表示为ΔH1-ΔH3
C.ΔH2>ΔH4
D.升温时,丙烷与Cl反应速率加快,与Br反应速率降低
【答案】A
【解析】
A、①ΔH2 CH3CH2CH3 +Cl→CH(CH3)2 + HCl ΔH2
②CH3CH2CH3+Br→CH3CH2CH2+ HBr ΔH3
③CH3CH2CH3+Br→CH(CH3)2+HBr ΔH4
根据盖斯定律①+②-③得CH3CH2CH3 +Cl→CH3CH2CH2+HCl ΔH1=ΔH2+ΔH3-ΔH4,故A正确;
B、根据焓变=反应物的总键能-生成物的总键能,HCl和HBr的键能差可以表示为ΔH3-ΔH1,故B错误;
C、焓变=反应物的总键能-生成物的总键能,HCl的键能大于HBr,所以ΔH2<ΔH4,故C错误;
D、升温时,反应速率加快,所以升高温度丙烷与Cl反应速率、丙烷与Br反应速率均加快,故D错误。


科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究铁离子与硫离子的反应,实验操作及现象如表:下列有关说法错误的( )
| 滴入FeCl3溶液立刻有黑色沉淀生成继续滴入FeC13溶液,黑色沉淀增多后又逐渐转化为黄色沉淀 |
| 滴入Na2S溶液立刻生成黑色沉淀,沉淀下沉逐渐转化为黄色。继续滴入Na2S溶液,最后出现黑色的沉淀 |
A.两次实验中,开始产生的黑色沉淀都为Fe2S3
B.两次实验中,产生的黄色沉淀是因为发生了反应Fe2S3+4FeCl3═6FeCl2+3S
C.向稀FeCl3溶液中逐滴加入稀Na2S溶液至过量最后生成的黑色沉淀为FeS
D.在Na2S溶液过量的情况下,黑色沉淀中存在较多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为某学习小组探究用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物的实验装置。
(1)甲同学设计如图所示的实验装置检验气体产物。
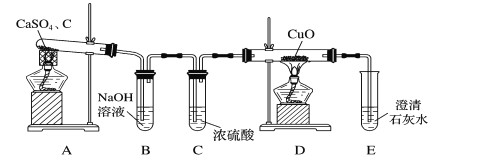
①B装置的作用是___。
②D和E装置能检验装置A的反应产物中有气体__(填化学式),能说明产生有该气体的现象是__。
(2)乙同学根据氧化还原反应原理,提出装置A产生的气体产物中可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
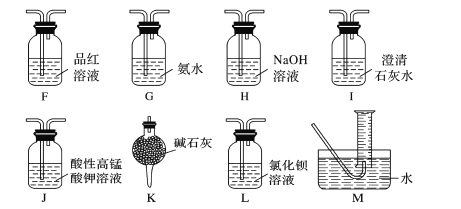
①气流从左至右,仪器连接顺序为A、F、__、M。
②能证明有CO2的现象是__。
③除去SO2的离子方程式为__。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是
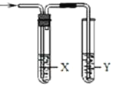
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
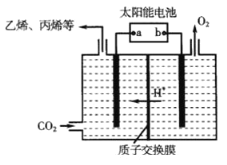
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应 ①自发进行的条件是________________,ΔH3 =_____________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
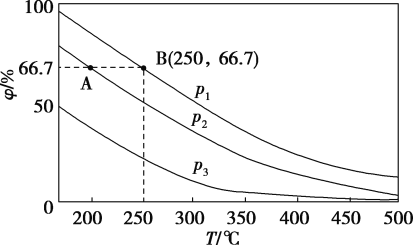
①其中,p1、p2和p3由大到小的顺序是________,其原因是_________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
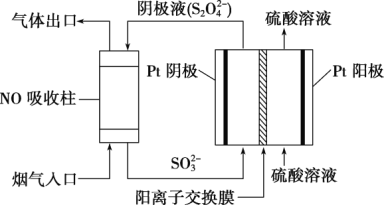
①阴极区的电极反应式为_____________________________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。
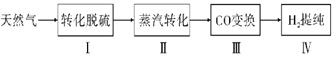
请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如下。
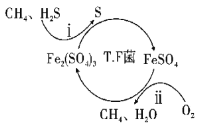
(1)过程i的离子反应方程式为__。
(2)已知:
①Fe3+在pH=1.9时开始沉淀pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
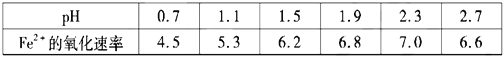
下列说法正确的是___
A.在转化脱硫中,最佳的pH范围是1.5<pH<1.9
B.在转化脱硫中需要不断补充Fe2(SO4)3
C.在转化脱硫中是O2间接地把H2S氧化为S
D.在转化脱硫中CH4作为还原剂被氧化
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。

(3)①该过程的热化学方程式是__。
②比较压强p1和p2的大小关系:p1__p2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程示意图如图。
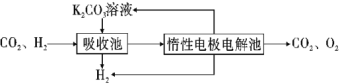
(4)吸收池中发生反应的离子方程式是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com