
【题目】以下为某学习小组探究用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物的实验装置。
(1)甲同学设计如图所示的实验装置检验气体产物。
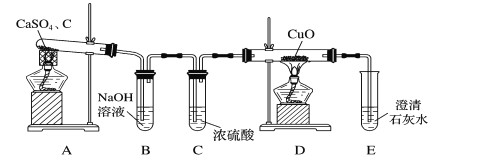
①B装置的作用是___。
②D和E装置能检验装置A的反应产物中有气体__(填化学式),能说明产生有该气体的现象是__。
(2)乙同学根据氧化还原反应原理,提出装置A产生的气体产物中可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
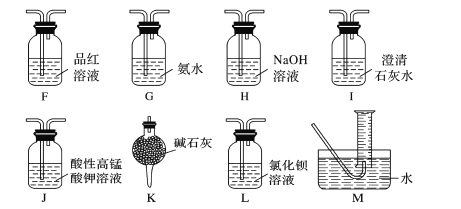
①气流从左至右,仪器连接顺序为A、F、__、M。
②能证明有CO2的现象是__。
③除去SO2的离子方程式为__。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:__。
【答案】除去酸性气体 CO 黑色氧化铜变红,澄清石灰水变浑浊 J、F、I 第二个F中的品红不退色,I中的澄清石灰水变浑浊 5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+ 2CaSO4+3C![]() CaS+CaO+SO2↑+CO↑+2CO2↑
CaS+CaO+SO2↑+CO↑+2CO2↑
【解析】
硫酸钙和焦炭在高温下反应制备硫化钙的方程式里可能产生使氧化铜还原的气体应为CO,CuO氧化CO生成红色的Cu和CO2,CO2使石灰水变浑浊。验证A中的气体产物可能还有CO2、SO2,必须先用品红验证SO2后再用酸性高锰酸钾除去SO2,再用澄清石灰水检验CO2。根据检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出方程式:2CaSO4+3C![]() CaS+CaO+SO2↑+2CO2↑+CO↑,据此分析解答。
CaS+CaO+SO2↑+2CO2↑+CO↑,据此分析解答。
(1) ①硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,除此之外还可能有CO2、SO2等,会干扰CO的检验,因此氢氧化钠溶液可吸收除去酸性气体,排除对CO检验的干扰;
②通过一氧化碳还原,氧化铜由黑色变红色,生成的CO2能够使澄清石灰水变浑浊,说明装置A的反应产物是CO;
(2)①装置A中的气体产物可能含有SO2和CO2,根据装置图,可以通过品红溶液检验二氧化硫,除去二氧化硫后再用澄清石灰水检验二氧化碳,因此气流从左到右的仪器连接顺序为A、F、J、F、I、M;
②能证明有二氧化碳的现象是第二个F中品红不退色,I中的澄清石灰水变浑浊;
③装置J中酸性高锰酸钾将二氧化硫氧化,反应的离子方程式为5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+;
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,反应的化学方程式为2CaSO4+3C=高温CaS+ CaO+ SO2↑+CO↑+2CO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
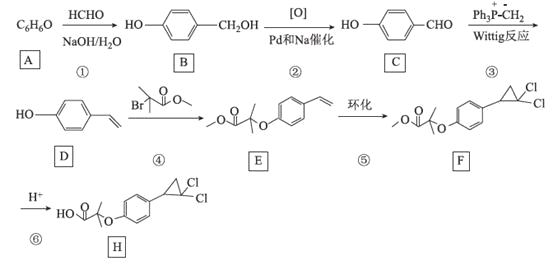
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二正丁基锡羧酸酯是一种良好的大肠杆菌,枯草杆菌的杀菌剂。合成一种二正丁基锡羧酸酯的方法如图1:

将0.45g的2-苯甲酰基苯甲酸和0.500g的二正丁基氧化锡加入到50mL苯中,搅拌回流分水6小时。水浴蒸出溶剂,残留物经重结晶得到白色针状晶体。
各物质的溶解性表
物质 | 水 | 苯 | 乙醇 |
2-苯甲酰基苯甲酸 | 难溶 | 易溶 | 易溶 |
二正丁基氧化锡 | 难溶 | 易溶 | 易溶 |
正丁基锡羧酸酯 | 难溶 | 易溶 | 易溶 |
回答下列问题:
(1)仪器甲的作用是___,其进水口为___。
(2)实验不使用橡胶塞而使用磨口玻璃插接的原因是___。
(3)分水器(乙)中加蒸馏水至接近支管处,使冷凝管回流的液体中的水冷凝进入分水器,水面上升时可打开分水器活塞放出,有机物因密度小,位于水层上方,从分水器支管回流入烧瓶。本实验选用的分水器的作用是__(填标号)
A.能有效地把水带离反应体系,促进平衡向正反应方向移动
B.能通过观察水面高度不再变化的现象,判断反应结束的时间
C.分离有机溶剂和水
D.主要起到冷凝溶剂的作用
(4)回流后分离出苯的方法是__。
(5)分离出苯后的残留物,要经重结晶提纯,选用的提纯试剂是__(填标号)
A.水 B.乙醇 C.苯
(6)重结晶提纯后的质量为0.670g,计算二正丁基锡羧酸酯的产率约为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员借助太阳能,将H2S转化为可再利用的S和H2的工作原理如图所示。下列叙述错误的是( )
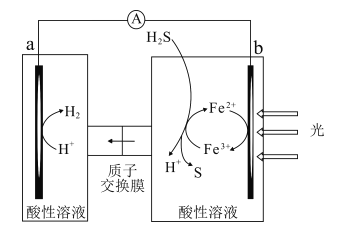
A.该电池能实现将光能转化为化学能
B.a电极的电极反应:2H++2e-=H2↑
C.光照后,b电极的电极反应:H2S-2e-=2H++S
D.a电极区溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度。则表示25℃的是________(填“A”或“B”)。100℃时,在1molL﹣1的NaOH溶液中,由水电离出的c(H+)=________molL﹣1 。 100℃时,5×10﹣5 molL﹣1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为________。
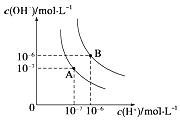
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
CH3CH2CH2+HCl![]() CH3CH2CH3 +Cl
CH3CH2CH3 +Cl![]() CH(CH3)2 + HCl
CH(CH3)2 + HCl
CH3CH2CH2+ HBr![]() CH3CH2CH3+Br
CH3CH2CH3+Br![]() CH(CH3)2+HBr
CH(CH3)2+HBr
下列说法正确的是( )
A.ΔH1=ΔH2+ΔH3-ΔH4
B.HCl和HBr的键能差可以表示为ΔH1-ΔH3
C.ΔH2>ΔH4
D.升温时,丙烷与Cl反应速率加快,与Br反应速率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
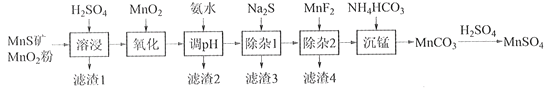
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是( )
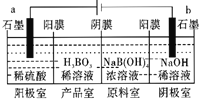
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大,阳极室H2SO4浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.电解过程中,B(OH)4-穿过阴膜进入产品窒,Na+穿过阳膜进入阴极室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com