
【题目】水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度。则表示25℃的是________(填“A”或“B”)。100℃时,在1molL﹣1的NaOH溶液中,由水电离出的c(H+)=________molL﹣1 。 100℃时,5×10﹣5 molL﹣1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为________。
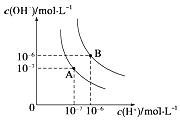
【答案】A 1×10﹣12 9:1
【解析】
根据c(OH-)=c(H+)=1×10﹣7 mol·L-1,得出25℃的点;根据100℃时水的离子积常数,得出水电离出的氢离子浓度;100℃时,先求H2SO4溶液c(H+)和Ba(OH)2溶液的c(OH-),再根据混合后呈碱性进行计算。
A点c(OH-)=c(H+)=1×10﹣7 mol·L-1,则表示25℃的是A;100℃时,c(OH-)=c(H+)=1×10﹣6 mol·L-1,在1molL﹣1的NaOH溶液中,由水电离出的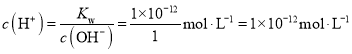 ;100℃时,5×10﹣5 molL﹣1的H2SO4溶液中c(H+)=5×10﹣5 molL﹣1×2=1×10﹣4 mol·L-1,pH=9的Ba(OH)2溶液中c(OH-)= 1×10﹣3 mol·L-1,混合后pH=7,溶液呈碱性,c(OH-)=1×10﹣5 mol·L-1,
;100℃时,5×10﹣5 molL﹣1的H2SO4溶液中c(H+)=5×10﹣5 molL﹣1×2=1×10﹣4 mol·L-1,pH=9的Ba(OH)2溶液中c(OH-)= 1×10﹣3 mol·L-1,混合后pH=7,溶液呈碱性,c(OH-)=1×10﹣5 mol·L-1,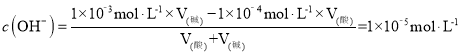 ,
,![]() ,即混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1,故答案为:A;1×10﹣12;9:1。
,即混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1,故答案为:A;1×10﹣12;9:1。


科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])在工业上主要应用于制药、电镀、造纸、钢铁生产,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。回答下列问题:
(1)Fe3+比Fe2+稳定的原因______。
(2)在[Fe(CN)6]3-中不存在的化学键为______。
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为______。
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是______,分子中σ键和π键数目之比为______。
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______。
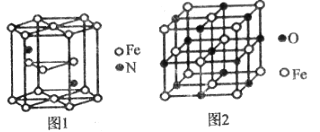
(5)已知:氧化亚铁晶体的密度为pgcm-3,NA表示阿伏加德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______;Fe2+与O2-的最短核间距为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器甲乙丙中,分别依次加入下列各选项中所对应的试剂进行实验。能达到实验目的的是( )
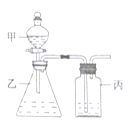
A.浓盐酸、高锰酸钾、浓硫酸,制取纯净的氯气
B.浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
C.稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有碳酸根离子
D.稀硫酸、碳酸钠、次氯酸钠,验证硫酸、碳酸、次氯酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
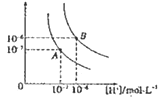
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为某学习小组探究用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物的实验装置。
(1)甲同学设计如图所示的实验装置检验气体产物。
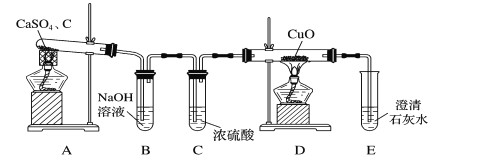
①B装置的作用是___。
②D和E装置能检验装置A的反应产物中有气体__(填化学式),能说明产生有该气体的现象是__。
(2)乙同学根据氧化还原反应原理,提出装置A产生的气体产物中可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
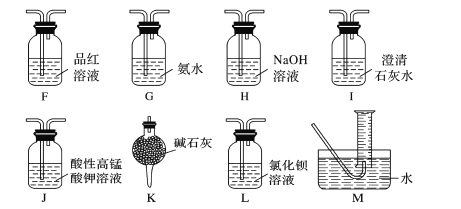
①气流从左至右,仪器连接顺序为A、F、__、M。
②能证明有CO2的现象是__。
③除去SO2的离子方程式为__。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
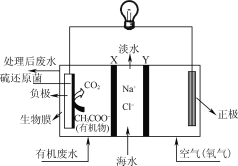
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是
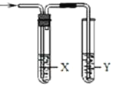
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
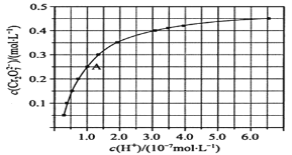
(1)CrO42-和Cr2O72-在溶液中相互转化的离子方程式___。
(2)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
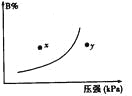
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
A.①②⑤B.②④⑤
C.只有①③D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com