
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
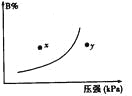
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
A.①②⑤B.②④⑤
C.只有①③D.①③⑤
科目:高中化学 来源: 题型:
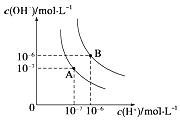
【题目】水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度。则表示25℃的是________(填“A”或“B”)。100℃时,在1molL﹣1的NaOH溶液中,由水电离出的c(H+)=________molL﹣1 。 100℃时,5×10﹣5 molL﹣1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知![]() 的电离平衡常数
的电离平衡常数![]() ,向0.1mol/L
,向0.1mol/L![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() 1:18,此时溶液PH=________。
1:18,此时溶液PH=________。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的热化学反应方程式为:___________________________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
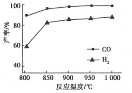
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________。
(4)已知2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________。
③达到平衡后CH3OH的浓度为_____________。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料![]() 结构简式为
结构简式为![]() ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
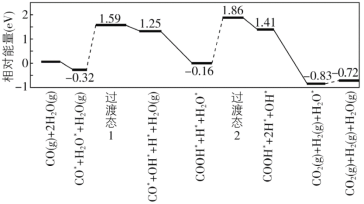
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: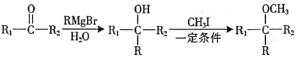 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以![]() 为原料制备
为原料制备![]() 的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________。
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T是一种有机药物,其合成路线如图:

已知:① ;
;
②
(1)Z中含氧官能团的名称为_______________。
(2)R的分子式为_________,R经过反应可生成S,写出S的结构简式:__________________。
(3)![]() 的反应方程式为________________、
的反应方程式为________________、![]() 的反应类型为________________。
的反应类型为________________。
(4)W是T的一种同分异构体,满足下列条件的W的结构有______________种,写出其中一种的结构简式:___________________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与![]() 溶液发生显色反应;
溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(5)结合本题信息,请以2-甲基-1-丙醇( )、苯为原料来合成X,写出有关的合成路线流程图(无机试剂任选)____________。合成路线流程图示例如下:
)、苯为原料来合成X,写出有关的合成路线流程图(无机试剂任选)____________。合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是( )
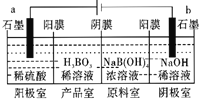
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大,阳极室H2SO4浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.电解过程中,B(OH)4-穿过阴膜进入产品窒,Na+穿过阳膜进入阴极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
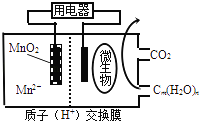
A.放电过程中,H+从正极区移向负极区
B.分子组成为Cm(H2O)n的物质一定是糖类
C.微生物所在电极区放电时发生还原反应
D.左边电极反应式为:MnO2+4H++2e﹣=Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式为__。
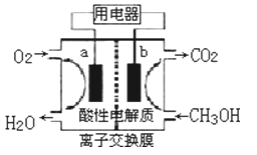
(2)以甲醇做燃料的电池,如图所示,其负极是__(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为__。
(3)已知:NO2(g)+SO2(g)SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=__。当给已达平衡状态的上述反应升温时,平衡常数K′__。(变大、变小或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,用0.1mol·L-1的氨水滴定10mL0.05mol·L-1的二元酸H2X溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
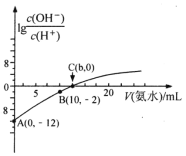
A.A点的pH等于2
B.B点溶液中离子浓度大小顺序为:c(NH4+)>c(X2-)>c(H+)>c(HX-)>c(OH-)
C.由图可知,25℃时,NH3·H2O的Kb=![]()
D.A点到C点,水的电离程度先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com