
【题目】按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知![]() 的电离平衡常数
的电离平衡常数![]() ,向0.1mol/L
,向0.1mol/L![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() 1:18,此时溶液PH=________。
1:18,此时溶液PH=________。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的热化学反应方程式为:___________________________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
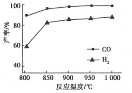
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________。
(4)已知2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________。
③达到平衡后CH3OH的浓度为_____________。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料![]() 结构简式为
结构简式为![]() ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
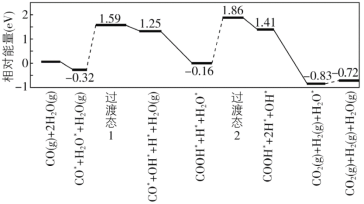
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: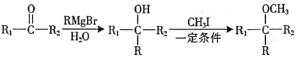 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以![]() 为原料制备
为原料制备![]() 的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________。
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________。
【答案】S2O32-+2H+=S↓+SO2↑+H2O 减少 6 CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH=+120kJ·mol-1 B 900℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低 右 0.005mol/(Lmin) 0.12mol/L nHOOCCOOH+nHOCH2CH2OH
2CO(g)+2H2(g) ΔH=+120kJ·mol-1 B 900℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低 右 0.005mol/(Lmin) 0.12mol/L nHOOCCOOH+nHOCH2CH2OH![]()
![]() +(2n-1)H2O 2-甲基-1,3-丁二烯或异戊二烯 HCOOC(CH3)2CH2CH3 小于 2.02 COOH*+H*+H2O*=COOH*+2H*+OH*(或H2O*=H*+OH*)
+(2n-1)H2O 2-甲基-1,3-丁二烯或异戊二烯 HCOOC(CH3)2CH2CH3 小于 2.02 COOH*+H*+H2O*=COOH*+2H*+OH*(或H2O*=H*+OH*) ![]()
【解析】
(1)S2O32-在酸性条件下发生歧化反应生成硫单质和二氧化硫气体;升高温度,反应速率加快。
(2)根据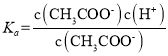 计算。
计算。
(3)①根据焓变=反应物的总键能-生成物的总键能计算反应热;正反应气体物质的量增大,恒容容器与恒压容器比,相当于加压;
②900℃时,合成气产率已经较高,再升高温度产率增幅不大。
(4)①根据Q、K的关系判断反应方向;
②根据![]() 计算速率;
计算速率;
③利用“三段式”计算平衡后CH3OH的浓度。
(8)根据图示,CO(g)和H2O(g)的能量大于CO2(g)和H2(g);根据图示判断正反应活化能的最大值。
(1)S2O32-在酸性条件下发生歧化反应生成硫单质和二氧化硫气体,将等浓度的Na2S2O3溶液与硫酸溶液混合,反应的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O;升高温度,反应速率加快,若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将减少。
(2)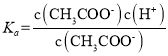 =1.8×10-5,当c(CH3COOH:c(CH3COO-)=1:18,c(H+)=1×10-6,溶液pH=6。
=1.8×10-5,当c(CH3COOH:c(CH3COO-)=1:18,c(H+)=1×10-6,溶液pH=6。
(3)①焓变=反应物的总键能-生成物的总键能,CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=413×4+745×2-1075×2-436×2=+120kJ·mol-1;CH4(g)+CO2(g)
2CO(g)+2H2(g) ΔH=413×4+745×2-1075×2-436×2=+120kJ·mol-1;CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) 正反应气体物质的量增大,A容器内气体压强增大,压强A>B,增大压强平衡逆向移动,由于正反应为吸热反应,所以两容器中反应达平衡后吸收的热量较多的是B;
2CO(g)+2H2(g) 正反应气体物质的量增大,A容器内气体压强增大,压强A>B,增大压强平衡逆向移动,由于正反应为吸热反应,所以两容器中反应达平衡后吸收的热量较多的是B;
②900℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低,所以此反应优选温度为900℃。
(4)①Q=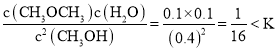 ,所以反应向右进行;
,所以反应向右进行;
②由表中数据可知,从加入CH3OH开始反应到20min时,CH3OCH3的变化量为0.1mol/L,所以,![]() =
=![]() 0.005mol/(Lmin) ;
0.005mol/(Lmin) ;
③
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
开始 0.4 0.1 0.1
转化 2x x x
平衡 0.4-2x 0.1+x 0.1+x
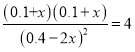 ,x=0.14,所以达到平衡后CH3OH的浓度为0.4+0.28=0.12 mol/L。
,x=0.14,所以达到平衡后CH3OH的浓度为0.4+0.28=0.12 mol/L。
(5)乙二酸、乙二醇在浓硫酸作用下发生缩聚反应生成聚乙二酸乙二酯和水,反应的反应方程式为nHOOCCOOH+nHOCH2CH2OH![]()
![]() +(2n-1)H2O。
+(2n-1)H2O。
(6)![]() 为加聚反应的产物,合成
为加聚反应的产物,合成![]() 的单体有丙烯氰(CH2=CHCN)、2-甲基-1,3-丁二烯(
的单体有丙烯氰(CH2=CHCN)、2-甲基-1,3-丁二烯(![]() )、2-甲基苯乙烯(
)、2-甲基苯乙烯(![]() ),还需要的单体名称是2-甲基-1,3-丁二烯。
),还需要的单体名称是2-甲基-1,3-丁二烯。
(7)C6H12O2与稀硫酸共热生成A和B,说明C6H12O2是饱和一元酯,酸性条件下水解为酸和醇,A能够发生银镜反应,说明A是甲酸,B不能发生催化氧化反应,说明该醇的α-C上没有H原子,B的结构简式是HOC(CH3)2CH2CH3,所以有机物R的结构简式是HCOOC(CH3)2CH2CH3。
(8)根据图示,CO(g)和H2O(g)的能量大于CO2(g)和H2(g),所以水煤气变换的ΔH小于0;根据图示,正反应活化能的最大值为1.86-(-0.16)=2.02 eV;该历程为COOH*+H*+H2O*生成COOH*+2H*+OH*,反应方程式是COOH*+H*+H2O*=COOH*+2H*+OH*。
(9)n(A)=0.1mol;燃烧后产生的各物质的物质的量是:n(H2O)= 5.4 g÷18g/mol=0.3mol,n(CO2)= 13.2 g÷44g/mol=0.3mol,则一个分子中含有3个C和6个H,因此,其中的O原子数为(90-12×3-1×6)÷16=3,因此该物质的分子式是C3H6O3;A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物,说明A分子中含有羧基、羟基,A的结构简式是HOCH2CH2COOH,则A在一定条件下发生缩聚反应的产物的结构简式是![]() 。
。
(10)![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ;
;![]() 发生催化氧化生成
发生催化氧化生成![]() ;由题中信息可知,
;由题中信息可知,![]() 与CH3MgBr反应生成
与CH3MgBr反应生成 在浓硫酸作用下发生消去反应生成
在浓硫酸作用下发生消去反应生成![]() 。因此,合成路线可以设计为:
。因此,合成路线可以设计为: 。
。


科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器甲乙丙中,分别依次加入下列各选项中所对应的试剂进行实验。能达到实验目的的是( )
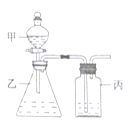
A.浓盐酸、高锰酸钾、浓硫酸,制取纯净的氯气
B.浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
C.稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有碳酸根离子
D.稀硫酸、碳酸钠、次氯酸钠,验证硫酸、碳酸、次氯酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是
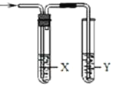
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
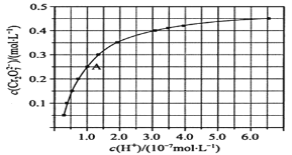
(1)CrO42-和Cr2O72-在溶液中相互转化的离子方程式___。
(2)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应 ①自发进行的条件是________________,ΔH3 =_____________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
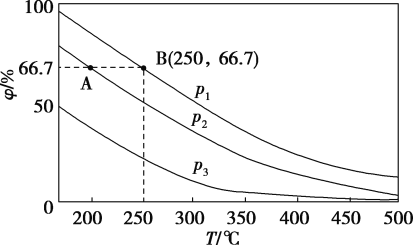
①其中,p1、p2和p3由大到小的顺序是________,其原因是_________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
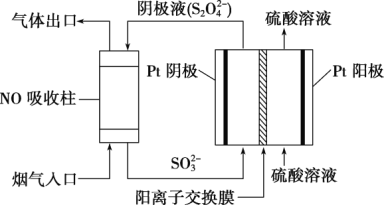
①阴极区的电极反应式为_____________________________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不盛”。青矾厂气是![]() 和
和![]()
B.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
C.“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾”,其中涉及的操作有结晶
D.推广使用煤液化技术可以减少温室气体二氧化碳的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 和
和![]() 在工业生产中有重要的应用。
在工业生产中有重要的应用。
(1)用![]() 处理废气中的
处理废气中的![]() 会生成
会生成![]() 、
、![]() 两种单质。在该反应中,氧化剂与还原剂的物质的量之比为_________________________。
两种单质。在该反应中,氧化剂与还原剂的物质的量之比为_________________________。
(2)利用![]() 可消除
可消除![]() 污染,其反应为
污染,其反应为![]() ,不同温度下,向装有足量
,不同温度下,向装有足量![]() 固体的
固体的![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() ,测得
,测得![]() 气体的体积分数
气体的体积分数![]() 随时间
随时间![]() 的变化曲线如图所示。
的变化曲线如图所示。

①温度为T2时,![]() 内,
内,![]() 的平均反应速率
的平均反应速率![]() _____________________。
_____________________。
②该反应的![]() ________0(填“>”“<”或“=”),判断的理由是_________________。
________0(填“>”“<”或“=”),判断的理由是_________________。
(3)常温下,已知![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() ,通过计算可得
,通过计算可得![]() 的
的![]() 溶液
溶液![]() ___________。
___________。
(4)为了确定![]() 氧化速率方程式
氧化速率方程式![]() 中
中![]() 的值(取整数),进行了相应实验。当溶解
的值(取整数),进行了相应实验。当溶解![]() 的浓度为
的浓度为![]() 时,
时,![]() 与速率(
与速率(![]() )数值的关系如下表所示,则
)数值的关系如下表所示,则![]() _______。
_______。
| 3.65 | 7.30 | 10.95 | 14.60 |
| 10.2 | 40.80 | 91.80 | 163.20 |
(5)某工业废水中含有![]() 、
、![]() 等离子。取一定量的该工业废水,向其中滴加
等离子。取一定量的该工业废水,向其中滴加![]() 溶液,当
溶液,当![]() 开始沉淀时,溶液中
开始沉淀时,溶液中 _______(保留两位有效数字)。(已知:25℃时,
_______(保留两位有效数字)。(已知:25℃时, ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
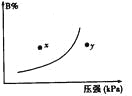
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
A.①②⑤B.②④⑤
C.只有①③D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com