
����Ŀ��������(MoS2�� ����Mo�Ļ��ϼ�Ϊ+4)����Ϊ��������֮���������õ�Ʒ�ʵĻ����(��MoS2��SiO2 �Լ�CuFeS2������)�Ʊ��ߴ��������һ�������������£�

�ش��������⣺
(1)��������м����������Ϊ�˳�ȥ����SiO2���÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(2)����������������������Ҫ�ǽ�MoS2ת��ΪMoO3���ڸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��
(3)���������ղ�������ս���������������ǰ������з��鴦������Ŀ����_________����������������( NH4)2 MoO4��Ӧ�Ļ�ѧ����ʽΪ___________��
(4)���������������Һ�м���Na2S�������ת��Ϊ��������[(NH4)2MoS4]�����������(NH4)2 MoS4�����ᷴӦ����MoS3������������Ӧ�����ӷ���ʽΪ_________________��
(5)�ߴ�MoS2����Ȼ����ڼ����ķ����Ⱦ���MoS2.8�����ʣ��ڸ�������Ϊ���ֵ����ԣ�MoԪ����+4��+6���ּ�̬����MoS2��Mo4+��ռMoԪ�ص����ʵ������� Ϊ__________��
Ϊ__________��
(6)�����ƾ���( Na2 MoO4 2H2O)��һ����������ȴˮϵͳ������ʴ����������MoS2�Ʊ������Ʊ������������Ba(OH)2�����ȥSO42-������Һ��c(MoO42-)=0.4 mol/L��c(SO42-)=0. 05 mol/L�������£���BaMoO4������ʼ����ʱ��SO42-��ȥ����Ϊ____________ [������Һ����仯����֪��259�棬Ksp( BaMoO4)=4.0��10-8 �� Ksp(BaSO4)=1.1��10-10]��
���𰸡�SiO2+4HF=SiF4��+2H2O 7��2 ����Ӧ��ĽӴ��������߽������� MoO3+2NH3H2O=(NH4)2MoO4+H2O MoS42-+2H+=MoS3��+H2S�� 1��5 97.8%
��������
(1)SiO2��HF��Ӧ����SiF4��H2O��
(2)���±��գ�MoS2��O2��Ӧ����MoO3��SO2����ϵ����غ㡢ԭ���غ���д��Ӧ����ʽ��Ȼ�����������ԭ��Ӧ�����ж����ʵ����ü���Ӧʱ���ʵ�����ϵ��
(3)������������������������ǰ��Ա�������з��飬Ŀ��������Ӧ��ĽӴ������ʹ��Ӧ��֣���߽������ʣ�����������(NH4)2MoO4ͬʱ����ˮ���÷�Ӧ�Ļ�ѧ����ʽ��MoO3+2NH3H2O=(NH4)2MoO4+H2O��
(4)(NH4)2MoS4�����ᷴӦ�õ�MoS3������H2S���壻
(5)����1mol��MoS2.8��Mo4+��Mo6+�����ʵ����ֱ���x��y�����������غ�ͻ����ﻯ�ϼ�Ϊ0��ʽ�ɵã�
(6)����Ksp( BaMoO4)=4.0��10-8��c(MoO42-)=0.4 mol/L�����γ�BaMoO4����ʱ��Һ��c(Ba2+)���ٽ��Ksp(BaSO4)=1.1��10-10������Һ��c(SO42-)��������ȥ���ʺ������SO42-��ȥ���ʣ�
(1) ����SiO2������ᷴӦ����SiF4��H2O����Ӧ����ʽΪSiO2+4HF=SiF4��+2H2O��
(2)���±��գ�MoS2��O2��Ӧ����MoO3��SO2����Ӧ����ʽΪ��2MoS2+7O2![]() 2MoO3+4SO2���ڸ÷�Ӧ��Mo��SԪ�ػ��ϼ����ߣ�ʧȥ���ӣ�����MoS2����ԭ����OԪ�ػ��ϼ۽��ͣ���õ��ӣ�����ԭ��O2�������������ڸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ7��2��
2MoO3+4SO2���ڸ÷�Ӧ��Mo��SԪ�ػ��ϼ����ߣ�ʧȥ���ӣ�����MoS2����ԭ����OԪ�ػ��ϼ۽��ͣ���õ��ӣ�����ԭ��O2�������������ڸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ7��2��
(3)������������������������ǰ��Ա�������з��飬Ŀ��������Ӧ��ĽӴ������ʹ��Ӧ��֣���߽������ʣ�����������(NH4)2MoO4��H2O���÷�Ӧ�Ļ�ѧ����ʽ��
MoO3+2NH3H2O=(NH4)2MoO4+H2O��
(4)(NH4)2MoS4����Һ��Ӧ�õ����NH4+��MoS42-��MoS42-�����Ի���������MoS3�����������������ֻ����H2S���壬�������ӷ���ʽΪ��MoS42-+2H+=MoS3��+H2S����
(5)����1mol��MoS2.8��Mo4+��Mo6+�����ʵ����ֱ���x��y����x+y=1�����ݻ��ϼ۴���֮��Ϊ0������4x+6y=2.8��2�����x=0.2��y=0.8�����Ը�������Mo4+��Mo6+�����ʵ���֮�� =0.2��(0.2+0.8)=1��5��
=0.2��(0.2+0.8)=1��5��
(6)��BaMoO4������ʼ����ʱ����Һ��c(Ba2+)=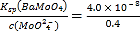 =1.0��10-7mol/L������Ksp(BaSO4)=1.1��10-10�����ʱ��Һ��SO42-��Ũ��Ϊc(SO42-)=
=1.0��10-7mol/L������Ksp(BaSO4)=1.1��10-10�����ʱ��Һ��SO42-��Ũ��Ϊc(SO42-)=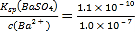 mol/L=1.1��10-3mol/L������SO42-��ȥ����Ϊ
mol/L=1.1��10-3mol/L������SO42-��ȥ����Ϊ![]() ��100%=97.8%��
��100%=97.8%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б����У���������
A.����֪Ũ�ȵ�NaOH��Һ�ⶨ�����Ũ�ȣ���ʽ�ζ���δ�ô�װ��Һ��ϴ����ɲⶨ���ƫ��
B.![]() ��Һ�У�
��Һ�У�![]()
C.�������Ũ�ȵ���������������ϣ�![]()
D.![]() ��ȵ�
��ȵ�![]() ��Һ��
��Һ��![]() ��Һ��
��Һ��![]() ��Һ��
��Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǴӺ���Һ�������ʯ�������ȡ�����Ҫ��Ӧ����2NaI��MnO2��3H2SO4===2NaHSO4��MnSO4��2H2O��I2 ;��2NaIO3��5NaHSO3===2Na2SO4��3NaHSO4��H2O��I2����˵����ȷ����(����)
A. �����ԣ�MnO2>SO![]() >IO
>IO![]() >I2
>I2
B. I2�ڷ�Ӧ�����ǻ�ԭ����ڷ�Ӧ��������������
C. ��Ӧ�٢������ɵ�����I2ʱת�Ƶ�����֮��Ϊ1��5
D. NaHSO3��Һ�����ԣ�NaHSO3��Һ��c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о���ѧ��ӦA+B=C+D�������仯�����ijͬѧ�������ͼ��ʾװ�á�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ���������Իش��������⣺

(1)�÷�ӦΪ________��Ӧ(��������������������)��
(2)A��B����������C��D��������_________(����������������)��
(3)�÷�Ӧ�������еĻ�ѧ��ͨ����ѧ��Ӧת����________�ͷų�����
(4)�÷�Ӧ�ķ�Ӧ�ﻯѧ���������յ�����________(����������������)�������ﻯѧ���γɷų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
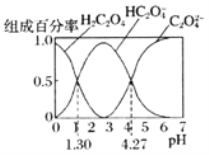
����Ŀ����֪![]() �Ƕ�Ԫ���ᣬ��������ijŨ�ȵIJ�����Һ����μ���KOH��Һ��������Һ��
�Ƕ�Ԫ���ᣬ��������ijŨ�ȵIJ�����Һ����μ���KOH��Һ��������Һ��![]() ��
��![]() ��
��![]() ����ɰٷ�����pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
����ɰٷ�����pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����![]()
A.![]() ����Һ�У�
����Һ�У�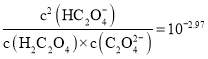
B.![]() ����Һ�У�
����Һ�У�![]()
C.��Ӧ![]() ��ƽ�ⳣ��Ϊ
��ƽ�ⳣ��Ϊ![]()
D.����Һ�м�KOH��Һ��pH��![]() ������
������![]() �Ĺ�����ˮ�ĵ���̶���������С
�Ĺ�����ˮ�ĵ���̶���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲�ͼʾ��Ȼ��ش����⣺
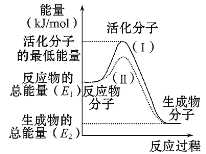
��ͼ����ʾ��Ӧ��_____(����ȡ����ȡ�)��Ӧ���÷�Ӧ�Ħ�H=____ (�ú�E1��E2�Ĵ���ʽ��ʾ)��
������ͼ��֪���ߢ�����ߢ�ͣ���������________��
(2)�״�������Ҫ�Ļ���ԭ��,�ֿ���Ϊȼ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������ºϳɼ״�,��������Ҫ��Ӧ����:��CO(g)+2H2(g)![]() CH3OH(g)��H1 ��CO2(g)+3H2(g)
CH3OH(g)��H1 ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��H2��CO2(g)+H2(g)
CH3OH(g)+H2O(g)��H2��CO2(g)+H2(g)![]() CO(g)+H2O(g)��H3����֪��Ӧ������صĻ�ѧ��������������:
CO(g)+H2O(g)��H3����֪��Ӧ������صĻ�ѧ��������������:
��ѧ�� | H-H | C-O |
| H-O | C-H |
E/ kJ��mol-1 | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼��㦤H1= _____kJ��mol-1����֪��H2=��58 kJ��mol-1����H3=___kJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���֪�Ʊ��״����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶�/�� | |
500 | 800 | ||
��2H2(g)��CO(g) | K1 | 2.5 | 0.15 |
��H2(g)��CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)��CO2(g) | K3 | ||
��1���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��______(��K1��K2��ʾ)��
��2����Ӧ�۵Ħ�H____0(���������)��
��3��500��ʱ��÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ����ȣ��Ҿ�Ϊ0.1mol��L��1�����ʱ����____����(�>������������<��)
��4��ij�¶�����2L�����ܱ������м���CH3OH������Ӧ2CH3OH��g��![]() CH3OCH3��g��+H2O��g��������й��������£�
CH3OCH3��g��+H2O��g��������й��������£�
��Ӧʱ��/min | 0 | 1 | 2 | 3 | 4 |
n��CH3OH��/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
�ٷ�Ӧ��2min����CH3OCH3��ʾ�Ļ�ѧ��Ӧ����Ϊ____��
�ڸ��¶��µķ�Ӧ��ƽ�ⳣ��Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Cu(NO3)2��ˮ��Һ��______����ᡱ�����С���������ԣ�����ʱ��pH _____7���>������=������<������ ԭ���ǣ������ӷ���ʽ��ʾ����_______________________________
��2����AlCl3��Һ���ɣ����գ����õ�����Ҫ���������________ ����Al2(SO4)3��Һ���ɵõ��Ĺ��������___________ ��
��3����Na2S��Һ�д��ڵĵ���غ�ʽΪ____________�����غ�ʽΪ___________�����غ�ʽΪ________________
��4����ĭ�������ԭ��(ҩƷ:Al2(SO4)3��Һ��NaHCO3��Һ)ԭ��Ϊ___________�����ӷ���ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ���������ֵ������˵����ȷ����( )
A.�ڱ�״���£�11.2L HF���еķ�����ĿΪ0.5NA
B.���³�ѹ�£�17g��(-14CH3)������������Ϊ9NA
C.17gH2O2�к��зǼ��Խ�����ĿΪNA
D.13.8gNO2������ˮ��Ӧ��ת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com