
����Ŀ��(1)�ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲�ͼʾ��Ȼ��ش����⣺
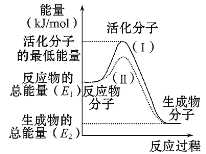
��ͼ����ʾ��Ӧ��_____(����ȡ����ȡ�)��Ӧ���÷�Ӧ�Ħ�H=____ (�ú�E1��E2�Ĵ���ʽ��ʾ)��
������ͼ��֪���ߢ�����ߢ�ͣ���������________��
(2)�״�������Ҫ�Ļ���ԭ��,�ֿ���Ϊȼ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������ºϳɼ״�,��������Ҫ��Ӧ����:��CO(g)+2H2(g)![]() CH3OH(g)��H1 ��CO2(g)+3H2(g)
CH3OH(g)��H1 ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��H2��CO2(g)+H2(g)
CH3OH(g)+H2O(g)��H2��CO2(g)+H2(g)![]() CO(g)+H2O(g)��H3����֪��Ӧ������صĻ�ѧ��������������:
CO(g)+H2O(g)��H3����֪��Ӧ������صĻ�ѧ��������������:
��ѧ�� | H-H | C-O |
| H-O | C-H |
E/ kJ��mol-1 | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼��㦤H1= _____kJ��mol-1����֪��H2=��58 kJ��mol-1����H3=___kJ��mol-1��
���𰸡����� ����E1-E2��kJ/mol �� ��E2-E1��kJ/mol ������� -99 +41
��������
��1������ͼ��֪���÷�Ӧ��Ӧ������������������������������H=�������������-��Ӧ�����������
�ڼ�������ɽ��ͷ�Ӧ�Ļ�ܣ�
��2��������H=��Ӧ����ܼ���-��������ܼ��ܼ�����H1�����ݸ�˹���ɽ��м��㡣
��1������ͼ��֪���÷�Ӧ��Ӧ����������������������������Ϊ���ȷ�Ӧ����H=�������������-��Ӧ���������= (E2-E1)kJ/mol��
����ͼ��֪���ߢ�����ߢ�ͣ���Ӧ�Ļ�ܽ��ͣ�����Ǽ��������ɵģ�
��2����H1=1076kJ/mol+2��436kJ/mol-3��413kJ/mol-343kJ/mol-465kJ/mol=-99 kJ��mol-1��
���ݸ�˹���ɣ���-��=�ۣ�����H3=-58kJ/mol-(-99kJ/mol)=+41 kJ��mol-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ����
A. pH=5��H2S��Һ�У�c(H+)= c(HS��)=1��10��5mol��L��1
B. pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1
C. pH=2��H2C2O4��Һ��pH=12��NaOH��Һ���������ϣ�c(Na��)+ c(H��)= c(OH��)+c( HC2O4��)
D. pH��ͬ����CH3COO Na��NaHCO3��NaClO������Һ��c(Na��)������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƹ�ҵ�ϣ�Ϊ����߶�п��Ч����ͨ������Zn(CN)42����Һ����Zn2+��Һ���е�⡣��ش��������⣺
(1)Ԫ��п�����ڱ��е�λ��Ϊ_____________����̬Zn�ļ۵����Ų�ʽΪ_____________��
(2)Zn(CN) 42������Ԫ���У��縺������Ԫ����_____________��Zn(CN) 42���к��еĻ�ѧ��������������_____________��
(3)CN����C���ӻ�����Ϊ_____________����CN����Ϊ�ȵ�����ĵ���Ϊ_____________��
(4)H2CO3��HNO3���������ϴ��������ԭ��_____________��
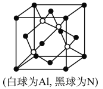
(5)N��Al�����һ�����Ͱ뵼�����AlN��AlN�������£���ĥ���ܡ��侧������Ϊ_____________���侧��ṹ��ͼ����֪�����߳�Ϊapm����AlN���ܶ�Ϊ_____________(�ú�a��NA�Ĵ���ʽ��ʾ)g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����aAm+��bBn-�ĺ�������Ų���ͬ,�����й�ϵ����ȷ���ǣ�������
A.���Ӱ뾶aAm+<bBn-
B.ԭ�Ӱ뾶A<B
C.A��ԭ��������B��ԭ��������(m+n)
D.b=a-n-m
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(MoS2�� ����Mo�Ļ��ϼ�Ϊ+4)����Ϊ��������֮���������õ�Ʒ�ʵĻ����(��MoS2��SiO2 �Լ�CuFeS2������)�Ʊ��ߴ��������һ�������������£�

�ش��������⣺
(1)��������м����������Ϊ�˳�ȥ����SiO2���÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(2)����������������������Ҫ�ǽ�MoS2ת��ΪMoO3���ڸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��
(3)���������ղ�������ս���������������ǰ������з��鴦������Ŀ����_________����������������( NH4)2 MoO4��Ӧ�Ļ�ѧ����ʽΪ___________��
(4)���������������Һ�м���Na2S�������ת��Ϊ��������[(NH4)2MoS4]�����������(NH4)2 MoS4�����ᷴӦ����MoS3������������Ӧ�����ӷ���ʽΪ_________________��
(5)�ߴ�MoS2����Ȼ����ڼ����ķ����Ⱦ���MoS2.8�����ʣ��ڸ�������Ϊ���ֵ����ԣ�MoԪ����+4��+6���ּ�̬����MoS2��Mo4+��ռMoԪ�ص����ʵ������� Ϊ__________��
Ϊ__________��
(6)�����ƾ���( Na2 MoO4 2H2O)��һ����������ȴˮϵͳ������ʴ����������MoS2�Ʊ������Ʊ������������Ba(OH)2�����ȥSO42-������Һ��c(MoO42-)=0.4 mol/L��c(SO42-)=0. 05 mol/L�������£���BaMoO4������ʼ����ʱ��SO42-��ȥ����Ϊ____________ [������Һ����仯����֪��259�棬Ksp( BaMoO4)=4.0��10-8 �� Ksp(BaSO4)=1.1��10-10]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��R��Ϊǰ20��Ԫ�أ���ԭ�Ӱ뾶�뻯�ϼ۵Ĺ�ϵ��ͼ��ʾ������˵���������

A.Qλ�ڵ������ڢ�A��
B.Z��M���������Ӧˮ�����Ϊǿ��
C.�����Ӱ뾶��M��R2+��Q+
D.X��Y��Z����Ԫ����ɵĻ�������ܺ������Ӽ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L���ܱ������У�X��Y��Z(��Ϊ����)�������ʵ�����ʱ��ı仯������ͼ��ʾ��

(1)��ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ__________��
(2)��������Ӧ��X��Y��Z�ֱ�ΪH2��N2��NH3��ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0mol N2��2.0mol H2��һ��ʱ���Ӧ��ƽ��״̬��ʵ�����������ʾ��
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s�ڵ�ƽ����Ӧ����v(N2)=__________��
(3)��֪������ָ�ڱ�״���£���1mol��̬����AB(g)����Ϊ��̬ԭ��A(g)��B(g)������������÷���E��ʾ����λΪkJ/mol��H-H�ļ���Ϊ436kJ/mol��N-H�ļ���Ϊ391kJ/mol������1mol NH3�����зų�46kJ����������N��N�ļ���Ϊ_________kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CrO42-+2H+Cr2O72-+H2O��25��ʱ�����ڳ�ʼŨ��Ϊ1.0molL-1��Na2CrO4��Һ��pH���ⶨƽ��ʱ��Һ��c(Cr2O72-)��c(H+)�������ͼ��ʾ�����ߡ�����˵������ȷ���ǣ� ��

A.ƽ��ʱ��pHԽС��c(Cr2O72-)Խ��
B.A��CrO42-��ƽ��ת����Ϊ50%
C.A��CrO42-ת��ΪCr2O72-��Ӧ��ƽ�ⳣ��K=1014
D.ƽ��ʱ������Һ��c(Cr2O72-)=c(CrO42-)����c(H+)>2.0��10-7molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T��ʱ��������(Ag2CrO4)��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ������˵���в���ȷ����
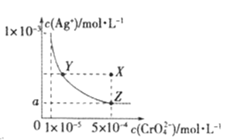
A.T��ʱ��Ag2CrO4 �� Ksp��ֵΪ 1��10-11
B.T��ʱ����Y���X�㣬ˮ�����ӻ�Kw���
C.ͼ��a=![]() ��10-4
��10-4
D.��Ag2CrO4��Һ�м������AgNO3��ʹ��Һ��Z���ΪX��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com