
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是

A.Q位于第三周期ⅠA族
B.Z与M的氧化物对应水化物均为强酸
C.简单离子半径:M>R2+>Q+
D.X、Y、Z三种元素组成的化合物可能含有离子键和共价键
【答案】B
【解析】
由图中可知,X显+1价,则最外层有1个电子,但原子半径小,所以其为氢(H);Y显-2价,不显正价,则其为氧(O);Z可以显-3、+5价,且半径比O大,则其为氮(N);M显-1、+7价,则其为氯(Cl);Q显+1价,且原子半径比Cl大,则其为钠(Na);R显+2价,原子半径比钠大,则其为钙(Ca)。
A.Q为钠(Na),在周期表中位于第三周期ⅠA族,A正确;
B.Z为氮(N)、M为氯(Cl),它们的最高价氧化物对应水化物均为强酸,但若不是最高价含氧酸,则不一定为强酸,B不正确;
C.Cl与Ca2+电子层结构相同,但Cl-的核电荷数小,所以半径Cl>Ca2+,Ca2+比Na+多一个电子层,离子半径Ca2+>Na+,C正确;
D.H、O、N三种元素组成的化合物NH4NO3既含有离子键,又含有共价键,D正确;
故选B。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】除去燃煤烟气中的有毒气体,一直是重要的科研课题。某科研小组设计如下装置模拟工业脱硫脱氮,探究SO2和NO同时氧化的吸收效果。模拟烟气由N2(90.02 %)、SO2(4.99%)、NO(4.99%)混合而成,各气体的流量分别由流量计控制,调节三路气体相应的流量比例,充分混合后进入A。(已知:FeSO4+NO![]() [Fe( NO)]SO4(棕色),下列说法不正确的是
[Fe( NO)]SO4(棕色),下列说法不正确的是

A. 反应开始前应该关闭d,打开e,通入一段时间的N2
B. 观察到装置A中有黑色固体生成,则A中反应为2H2O+3SO2+2MnO4—==3SO42—+2MnO2↓+4H+
C. 洗气瓶A的出气管口有两个玻璃球泡,目的是为了消除可能存在的未破裂的气泡
D. 实验中观察到B中红色褪去,C中变为浅棕色,说明KMnO4不能吸收NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明NaHCO3受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D. 同质量的甲和乙分别与足量的盐酸完全反应,产生二氧化碳的质量:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物B,B分子是四核的10电子分子。A的化学式是________。B与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;B分子的结构式________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到两种产物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

请回答:
(1写出甲池中正极的电极反应式:______________________;负极的电极反应式:______________________。
(2乙池中负极是_______;正极是_______。
(3)由此实验,可得到如下哪些正确结论?_______(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
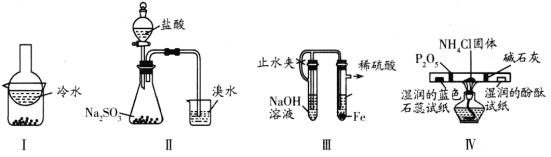
A. 加热装置Ⅰ中的烧杯分离I2和高锰酸钾固体
B. 用装置Ⅱ验证二氧化硫的漂白性
C. 用装置Ⅲ制备氢氧化亚铁沉淀
D. 用装置Ⅳ检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
① KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
② Fe2O3+2Al![]() Al2O3+2Fe; 1∶2
Al2O3+2Fe; 1∶2
③ 3NO2+H2O===2HNO3+NO; 2∶1
④ SiO2+3C===SiC+2CO↑; 1∶2
A.①③B.②③C.②④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应的离子方程式为:2Fe3++Fe![]() 3Fe2+,能实现该反应的原电池是
3Fe2+,能实现该反应的原电池是
A. 正极为Cu,负极为Fe,电解质为FeCl3溶液
B. 正极为C,负极为Fe,电解质为FeSO4溶液
C. 正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D. 正极为Ag,负极为Cu,电解质为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是________,B含有的官能团名称是________。
(2)反应④的反应类型是________。
(3)反应⑥的化学方程式为________。
(4)反应③⑤中引入-SO3H的作用是________。
(5)满足下列条件的C的同分异构体共有________种(不含立体异构)。
①能使FeCl3溶液显紫色;能发生水解反应。②苯环上有两个取代基。
其中核磁共振氢谱显示为5组峰,峰面积之比为3:2:2:2:1,且含有-CH2CH3,该有机物的结构简式是________ (任写一种)。
(6)以CH3CH2CH2OH为原料,设计制备 的合成路线:________。
的合成路线:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com