
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是________,B含有的官能团名称是________。
(2)反应④的反应类型是________。
(3)反应⑥的化学方程式为________。
(4)反应③⑤中引入-SO3H的作用是________。
(5)满足下列条件的C的同分异构体共有________种(不含立体异构)。
①能使FeCl3溶液显紫色;能发生水解反应。②苯环上有两个取代基。
其中核磁共振氢谱显示为5组峰,峰面积之比为3:2:2:2:1,且含有-CH2CH3,该有机物的结构简式是________ (任写一种)。
(6)以CH3CH2CH2OH为原料,设计制备 的合成路线:________。
的合成路线:________。
【答案】苯乙醛 氰基,羟基 取代反应  +nH2O 占据取代基的对位,将-NO2引入取代基的邻位 18
+nH2O 占据取代基的对位,将-NO2引入取代基的邻位 18 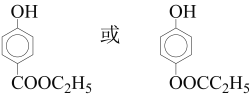 CH3CH2CH2OH
CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO ![]()
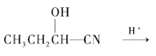

【解析】
通过比较反应物、生成物的组成结构,判断反应本质、反应类型、书写反应方程式。判断同分异构体、书写同分异构体,需逐一满足题目要求,并按一定顺序思考问题。对比原料、目标产物的结构,结合流程中的信息,运用逆合成分析法,解答物质合成题。
(1)由B结构简式知其分子式C9H9ON,则A(C8H8O)与HCN加成反应生成B,A结构简式为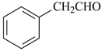 ,A的名称为苯乙醛。B中官能团的名称为氰基、羟基。
,A的名称为苯乙醛。B中官能团的名称为氰基、羟基。
(2)比较D、E结构知反应④的本质:D分子中苯环上1个氢原子被硝基取代生成E,故反应④属于取代反应。
(3)F分子中有羧基和羟基,可分子间酯化反应生成聚酯类高分子G,故反应⑥的化学方程式为 。
。
(4)反应③在苯环上原取代基的对位引入磺酸基(-SO3H),反应⑤磺酸基又消失,所以反应③~⑤中—SO3H的作用:可防止反应④中硝基(-NO2)进入原取代基的对位,即硝基(-NO2)只能进入原取代基的邻位。
(5)C的分子式为C9H10O3,其同分异构体要求有酚羟基(-OH)、酯基(-COO-)、二价苯基(-C6H4-);即合理结构中有HO-C6H4-,苯环上另一取代基可能为-COOC2H5、-OOCC2H5、-CH2COOCH3、-CH2OOCCH3、-CH2CH2OOCH、-CH(CH3)OOCH,共6种;两个取代基在苯环上有邻、间、对3种相对位置,符合要求的同分异构体有6×3=18种。其中有5种氢原子(数目之比为3:2:2:2:1)、含有-CH2CH3的结构简式是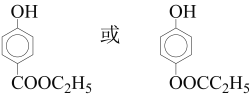 。
。
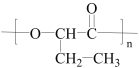
(6)目标产物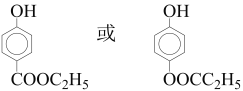 可由单体CH3CH2CH(OH)COOH分子间酯化反应(缩聚)生成,而单体CH3CH2CH(OH)COOH比原料CH3CH2CH2OH分子中多一个碳原子,故模仿流程中的反应①由CH3CH2CHO与HCN加成反应生成CH3CH2CH(OH)CN;模仿反应②CH3CH2CH(OH)CN酸性水解生成CH3CH2CH(OH)COOH;CH3CH2CH2OH催化氧化生成CH3CH2CHO;合成路线:
可由单体CH3CH2CH(OH)COOH分子间酯化反应(缩聚)生成,而单体CH3CH2CH(OH)COOH比原料CH3CH2CH2OH分子中多一个碳原子,故模仿流程中的反应①由CH3CH2CHO与HCN加成反应生成CH3CH2CH(OH)CN;模仿反应②CH3CH2CH(OH)CN酸性水解生成CH3CH2CH(OH)COOH;CH3CH2CH2OH催化氧化生成CH3CH2CHO;合成路线:
 。
。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是

A.Q位于第三周期ⅠA族
B.Z与M的氧化物对应水化物均为强酸
C.简单离子半径:M>R2+>Q+
D.X、Y、Z三种元素组成的化合物可能含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型锂离子电池的工作原理如图所示,其中a极区含有Li+、I-、I3-等离子的水溶液,电极b是一种固态有机聚合物。下列说法不正确的是

A. 充电时,a极区I3-的浓度增大
B. 充电时,电极b与外接电源的负极连接
C. 放电时,电极a可能发生反应I3-+2e-= 3I-
D. 放电时,外电路中每转移0. 1mol电子,电极b增重0.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

(1)以下叙述中,正确的是________(填字母)
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH 均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是______。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:______,总反应:______。 当电路中转移 0.25mol 电子时,消耗负极材料的质量为______g(Zn的相对原子质量为65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应进行分类时,既属于氧化还原反应又属于化合反应的是( )
A.2FeCl2+Cl2=2FeCl3B.Zn+H2SO4=ZnSO4+H2↑
C.CO2+CaO=CaCO3D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)是锂离子电池的一种重要正极材料。可利用湿法冶金工艺处理精选后的锂离子电池正极材料(LiCoO2、乙炔黑)重新制备高纯度LiCoO2,其流程如下。(已知:LiCoO2难溶于水,Li2CO3微溶于水、难溶于醇,CoCO3难溶于水和醇)

(l) H2O2的作用是____。
(2)“浸取”时若加入盐酸,Cl-被LiCoO2氧化产生Cl2。请写出该反应的离子方程式 ____。
(3)向含Co2+、Li+溶液中加入乙醇的作用 ___,滤渣b的主要成分是____(填化学式)。
(4)在空气中“煅烧”时发生的总化学方程式为 ___。
(5)可用碘量法来测定产品中钴的含量。取mg样品溶于稀硫酸,加入过量KI,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液进行滴定,达到滴定终点时,消耗Na2S2O3标准溶液VmL,则产品中钴的含量为____(以Co2O3计)。有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-= S4O62-+2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下,则反应NH3·H2O=NH4++OH-的焓变约为(单位:kJ·mol-1)
反应物 | 起始温度T1/℃ | 终止温度T2/℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
A. +2.1 B. +52.7 C. ;+4.2 D. -4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学小组拟用该装置制取纯净的O2。

(1)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是___。
(2)若C是一种黑色粉末,则B是_________,C的作用是________________。
(3)广口瓶中盛装的试剂D是___________,其作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,下列叙述正确的是
A.1molD2O所含质子数为12NA;B.1molNa2O2与足量水反应转移电子数为2NA;
C.10g 氖气所含原子数为0.5NA;D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com