
【题目】在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
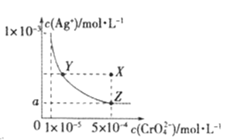
A.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
B.T℃时,在Y点和X点,水的离子积Kw相等
C.图中a=![]() ×10-4
×10-4
D.向饱和Ag2CrO4溶液中加入固体AgNO3能使溶液由Z点变为X点
【答案】D
【解析】
铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡方程式为Ag2CrO4(s)2Ag++CrO![]() ,结合Ksp=c2(Ag+)c(CrO
,结合Ksp=c2(Ag+)c(CrO![]() )分析解答。
)分析解答。
A.依据图象数据,曲线上的点是沉淀溶解平衡的点,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag++CrO![]() ,Ksp=c2(Ag+)c(CrO
,Ksp=c2(Ag+)c(CrO![]() )=(10-3)2×10-5=10-11,故A正确;
)=(10-3)2×10-5=10-11,故A正确;
B.一定温度下水的离子积Kw是常数,只随温度变化,不随浓度变化,所以T℃时,Y点和X点时水的离子积Kw相等,故B正确;
C.依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)c(CrO![]() )=1×10-11,Z点时c(CrO
)=1×10-11,Z点时c(CrO![]() )=5×10-4,则c(Ag+)2=2×10-8,所以a=
)=5×10-4,则c(Ag+)2=2×10-8,所以a=![]() ×10-4,故C正确;
×10-4,故C正确;
D.在饱和Ag2CrO4溶液中加入AgNO3固体,Ag2CrO4(s)2Ag++CrO![]() 平衡逆向移动,移动后,仍存在Ag2CrO4(s)2Ag++CrO
平衡逆向移动,移动后,仍存在Ag2CrO4(s)2Ag++CrO![]() ,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入AgNO3固体不能使溶液由Z点变为X点,故D错误;
,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入AgNO3固体不能使溶液由Z点变为X点,故D错误;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图示,然后回答问题:
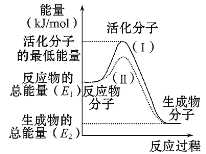
①图中所示反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=____ (用含E1、E2的代数式表示)。
②由上图可知曲线Ⅱ较曲线Ⅰ低,这是由于________。
(2)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)![]() CH3OH(g)ΔH1 ②CO2(g)+3H2(g)
CH3OH(g)ΔH1 ②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)
CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3。已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g)ΔH3。已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/ kJ·mol-1 | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1= _____kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯乙烯(![]() )的说法中不正确的是( )
)的说法中不正确的是( )
A. 分子中所有原子可能在同一个平面
B. 在一定条件下,1mol 苯乙烯最多消耗4mol H2
C. 和H2充分反应后的产物一氯代物有5种
D. 苯乙烯可发生还原反应、氧化反应、加成反应、加聚反应、取代反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是

A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.在标准状况下,11.2L HF含有的分子数目为0.5NA
B.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C.17gH2O2中含有非极性健的数目为NA
D.13.8gNO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为2:1,以下说法正确的是 ( )
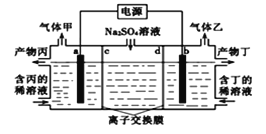
A. b电极反应式:2H2O+4e-=O2↑+4H+
B. 离子交换膜d为阴离子交换膜
C. 丙为硫酸溶液,丁为氢氧化钠溶液
D. a电极连接电源的正极作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
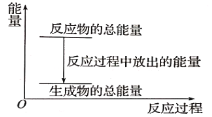
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上使用Au 基体催化CO2 合成甲酸的反应过程如图所示。下列说法不正确的是
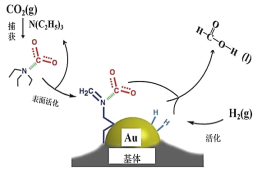
A.二氧化碳的电子式为![]()
B.在捕获过程,二氧化碳分子中的共价键完全断裂
C.N(C2H5)3 能够协助二氧化碳到达催化剂表面
D.CO2 催化加氢合成甲酸的总反应式为H2(g)+CO2(g)=HCOOH(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。某热再生浓差电池工作原理如图所示,通入NH3时电池开始工作,左侧电极质量减少,右侧电极质量增加,中间A为阴离子交换膜,放电后可利用废热进行充电再生。已知:Cu2++4NH3![]()
![]() ,下列说法不正确的是
,下列说法不正确的是
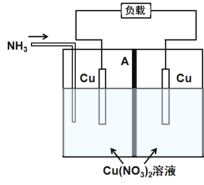
A.放电时,左侧电极发生氧化反应:Cu+4NH3-2e=![]()
B.放电时,电池的总反应为Cu2++4NH3![]()
![]() ,ΔH>0
,ΔH>0
C.放电时,![]() 经离子交换膜由右侧向左侧迁移
经离子交换膜由右侧向左侧迁移
D.上述原电池的形成说明,相同条件下,![]() 的氧化性比Cu2+的氧化性弱
的氧化性比Cu2+的氧化性弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com