
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是

A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc
【答案】D
【解析】
A.溶液的导电能力与离子浓度成正比,pH相等的醋酸钠和氢氧化钠,c(CH3COONa)>c(NaOH),所以c点导电能力大于b,即b、c两点溶液的导电能力不相同,故A正确;
B.氢氧化钠对水的电离起抑制作用,而醋酸根离子浓度越大对水的电离程度越促进,所以a、b、c三点溶液中水的电离程度a>c>b,故B正确;
C.任何电解质溶液中都存在质子守恒,根据质子守恒得C(H+)+C(CH3COOH)=C(OH-),故C正确;
D.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同体积相同pH的醋酸钠和氢氧化钠溶液消耗相同浓度的盐酸体积与氢氧化钠和醋酸钠的物质的量成正比,相同体积相同pH的醋酸钠和氢氧化钠溶液n(CH3COONa)>n(NaOH),所以醋酸钠消耗盐酸多,消耗盐酸体积Vb<Vc,故D错误;
故选D。
【点晴】
根据溶液中的溶质及其性质是解本题关键,再结合质子守恒、溶液导电能力与离子浓度的关系等知识点来分析解答;具体NaOH是强电解质,CH3COONa是强碱弱酸盐,加水稀释促进醋酸根离子水解,稀释相同的倍数时,溶液中c(OH-)CH3COONa>NaOH,所以pH变化大的是NaOH,则b为NaOH,变化小的是CH3COONa,即c为CH3COONa,据此可解题。


科目:高中化学 来源: 题型:
【题目】若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )
A.离子半径aAm+<bBn-
B.原子半径A<B
C.A的原子序数比B的原子序数大(m+n)
D.b=a-n-m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )

A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2SO3HSO3-+H+,Ka1;HSO3-SO32-+H+,Ka2。常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
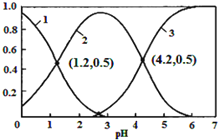
A.pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SO3)
B.常温下,![]() =1000
=1000
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小
D.曲线3表示的微粒是SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
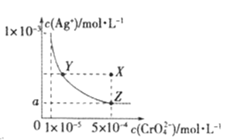
A.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
B.T℃时,在Y点和X点,水的离子积Kw相等
C.图中a=![]() ×10-4
×10-4
D.向饱和Ag2CrO4溶液中加入固体AgNO3能使溶液由Z点变为X点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容下,某容器中进行如下反应:H2![]() 2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
A.等于18sB.等于12sC.大于18sD.小于18s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:
准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
(1)高锰酸钾溶液应装在______________________________滴定管中。(填“酸式”或“碱式”)
(2)滴定至终点时的实验现象是:___________________________________
(3)下列操作可能使测量结果偏高的是__________________________________;
A、盛装的Na2C2O4的滴定管没润洗
B、盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C、读数时滴定前仰视,滴定后俯视
D、锥形瓶中残留少量水
(4)计算样品中Na2C2O4的纯度___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com