
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.在标准状况下,11.2L HF含有的分子数目为0.5NA
B.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C.17gH2O2中含有非极性健的数目为NA
D.13.8gNO2与足量水反应,转移的电子数为0.2NA
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测溶液pH可研究反应过程。用盐酸分别滴定Na2CO3、 NaHCO3溶液,测得pH随加入盐酸体积的变化如下图所示(曲线②从B1点开始滴定)。下列判断不正确的是

A. 曲线①表示用盐酸滴定Na2CO3的过程
B. B、C1点均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 曲线①、②说明Na2CO3与盐酸的反应分步进行
D. BC段和B1C1段发生的主要反应均是HCO3ˉ+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3H2O![]() +OH-,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)
+OH-,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)
①NH4Cl 固体 ②硫酸 ③NaOH 固体 ④水 ⑤加热
A.仅①②③⑤B.仅③⑤C.仅③D.仅①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
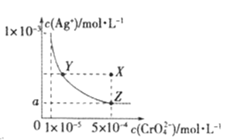
A.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
B.T℃时,在Y点和X点,水的离子积Kw相等
C.图中a=![]() ×10-4
×10-4
D.向饱和Ag2CrO4溶液中加入固体AgNO3能使溶液由Z点变为X点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是
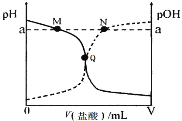
A.M点所示溶液c(![]() )+c(NH3·H2O)= c(Cl-)
)+c(NH3·H2O)= c(Cl-)
B.N点所示溶液中:c(![]() )>c(Cl-)
)>c(Cl-)
C.Q点所示消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
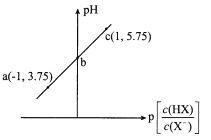
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用标准0.1400molL-1NaOH溶液滴定未知浓度硫酸的实验操作如下。
A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入酚酞。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL。
(1)①滴定操作的正确顺序是(用序号填写)___;②在G操作中如何确定终点?___。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)___。
(3)配制100mLNaOH标准溶液,必须使用到的玻璃仪器是___。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com