
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。某热再生浓差电池工作原理如图所示,通入NH3时电池开始工作,左侧电极质量减少,右侧电极质量增加,中间A为阴离子交换膜,放电后可利用废热进行充电再生。已知:Cu2++4NH3![]()
![]() ,下列说法不正确的是
,下列说法不正确的是
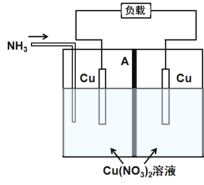
A.放电时,左侧电极发生氧化反应:Cu+4NH3-2e=![]()
B.放电时,电池的总反应为Cu2++4NH3![]()
![]() ,ΔH>0
,ΔH>0
C.放电时,![]() 经离子交换膜由右侧向左侧迁移
经离子交换膜由右侧向左侧迁移
D.上述原电池的形成说明,相同条件下,![]() 的氧化性比Cu2+的氧化性弱
的氧化性比Cu2+的氧化性弱
【答案】B
【解析】
A.根据题中给出的电池开始工作时,左侧电极质量减少,右侧电极质量增加,可知,左侧电极为负极,发生氧化反应,电极反应方程式为:Cu+4NH3-2e=![]() ,A项正确;
,A项正确;
B.通入NH3时电池开始工作,左侧电极质量减少,左侧电极反应方程式为:Cu+4NH3-2e=![]() ;右侧电极质量增加,则右侧电极作正极,其电极方程式为:Cu2++2e-=Cu,则电池的总反应为:Cu2++4NH3
;右侧电极质量增加,则右侧电极作正极,其电极方程式为:Cu2++2e-=Cu,则电池的总反应为:Cu2++4NH3![]()
![]() ,结合题给信息可知,ΔH<0,B项错误;
,结合题给信息可知,ΔH<0,B项错误;
C.放电时,阴离子向负极移动,阳离子向正极移动,结合题给信息,A为阴离子交换膜,则放电时,![]() 经离子交换膜由右侧向左侧迁移,C项正确;
经离子交换膜由右侧向左侧迁移,C项正确;
D.由原电池的总反应为氧化还原反应可知,氧化性:Cu2+>![]() ,D项正确;
,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
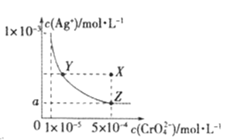
A.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
B.T℃时,在Y点和X点,水的离子积Kw相等
C.图中a=![]() ×10-4
×10-4
D.向饱和Ag2CrO4溶液中加入固体AgNO3能使溶液由Z点变为X点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了以下实验测定Cu—Ag合金与浓硝酸的反应。其实验装置如图:

请回答下列问题:
(1)F仪器的名称是_______________,作用是____________________________。
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为____________________________;装置A中盛放的是酸性高锰酸钾溶液,作用是___________________________________________。
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后__________(填操作步骤),再将B装置分液漏斗中的浓硝酸缓慢滴加到三颈烧瓶中。
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
滴定前体积/mL | 滴定后体积/mL | |
笫一次 | 0.33 | 20.32 |
笫二次 | 1.25 | 23.26 |
笫=.次 | 1.47 | 21.48 |
装置D中生成的硝酸为________mol,则Cu-Ag合金与浓硝酸反应过程中生成的NO2在标准状况下的体积为__________mL。
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积_________(填“偏大”或“偏小”),此时应将量气筒的位置_______(填“下移”或“上移”),以保证量气筒中的液面与干燥管中的液面持平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:
准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
(1)高锰酸钾溶液应装在______________________________滴定管中。(填“酸式”或“碱式”)
(2)滴定至终点时的实验现象是:___________________________________
(3)下列操作可能使测量结果偏高的是__________________________________;
A、盛装的Na2C2O4的滴定管没润洗
B、盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C、读数时滴定前仰视,滴定后俯视
D、锥形瓶中残留少量水
(4)计算样品中Na2C2O4的纯度___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用标准0.1400molL-1NaOH溶液滴定未知浓度硫酸的实验操作如下。
A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入酚酞。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL。
(1)①滴定操作的正确顺序是(用序号填写)___;②在G操作中如何确定终点?___。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)___。
(3)配制100mLNaOH标准溶液,必须使用到的玻璃仪器是___。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硼镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 和
和![]() 制取粗硼的工艺流程为:
制取粗硼的工艺流程为:
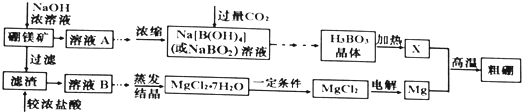
已知:![]() 硼与铝的性质相似,也能与氢氧化钠溶液反应.
硼与铝的性质相似,也能与氢氧化钠溶液反应.
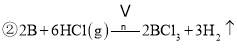
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,在潮湿空气中易形成白雾.
,在潮湿空气中易形成白雾.
I.回答下列问题:
![]() 证明溶液B中含有铁元素的方法是 ______
证明溶液B中含有铁元素的方法是 ______
![]() 与X反应制取粗硼的化学方程式 ______
与X反应制取粗硼的化学方程式 ______
![]() 上图中制取
上图中制取![]() 的“一定条件”是指 ______
的“一定条件”是指 ______
![]() 某同学设计如图所示装置制备三氯化硼.
某同学设计如图所示装置制备三氯化硼.

回答下列问题:
![]() 装置的作用是 ______ .
装置的作用是 ______ .
![]() 如果去掉B装置,可能的后果是 ______ .
如果去掉B装置,可能的后果是 ______ .

![]() 装置后面还应连接的一个装置是 ______ .
装置后面还应连接的一个装置是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质。
 (反应明显放热)
(反应明显放热)

实验中可能用到的数据:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g。
(1)在烧杯中配制该实验所需混酸的方法是___。
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和___。
(3)分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的___(填序号)。
a.温度计 b.蒸发皿 c.锥形瓶 d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为___。
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000molL-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg。
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该___。
②设计简单实验证明滤渣已经洗涤干净:___。
③原无机混合物中HNO3的浓度为___molL-1(用含V和W的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

回答下列问题:
![]() 中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为_______。
时锌浸出率最高的原因为_______。

![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
![]() “滤渣3”的主要成分为_______。
“滤渣3”的主要成分为_______。
![]() “电解”时
“电解”时![]() 在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的
在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,该气体是_______
溶液中,无明显现象,该气体是_______![]() 写化学式
写化学式![]() 。电解后的电解液经补充_______
。电解后的电解液经补充_______![]() 写一种物质的化学式
写一种物质的化学式![]() 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com