
【题目】2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质。
 (反应明显放热)
(反应明显放热)

实验中可能用到的数据:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g。
(1)在烧杯中配制该实验所需混酸的方法是___。
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和___。
(3)分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的___(填序号)。
a.温度计 b.蒸发皿 c.锥形瓶 d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为___。
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000molL-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg。
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该___。
②设计简单实验证明滤渣已经洗涤干净:___。
③原无机混合物中HNO3的浓度为___molL-1(用含V和W的代数式表示)。
【答案】分别量取10mL和30mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌 控制滴加混酸的速度 ac 53.2% 平视10.20mL的刻度线 取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净 0.1V-![]()
【解析】
⑴浓硫酸溶于水会放出大量的热,容易发生液体飞溅的情况,同时浓硝酸易挥发,混合一般是密度大的加入到密度小的里。
⑵控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度,操作ii是分离2-硝基甲苯和4-硝基甲苯,可以用蒸馏的方法,先求20.00 mL甲苯的物质的量,得出理论上产生硝基甲苯的质量,再计算产率。
⑷①量取过程中眼睛要平视酸式滴定管内液面;②滤渣表面可能有的杂质为氯离子;③先求NaOH的物质的量,也是原样品中混酸中氢离子的总物质的量,再求混酸中硫酸的物质的量,再求混酸中HNO3的物质的量,再求HNO3的浓度。
⑴浓硫酸溶于水会放出大量的热,容易发生液体飞溅的情况,同时浓硝酸易挥发,所以配制混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌;故答案为:分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌。
⑵控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度,操作ii是分离2-硝基甲苯和4-硝基甲苯,可以用蒸馏的方法,所以会用到温度计、锥形瓶,故选ac,20.00 mL甲苯的物质的量为![]() ,理论上产生硝基甲苯的质量为
,理论上产生硝基甲苯的质量为![]() ,所以产率为
,所以产率为![]() ;故答案为:控制滴加混酸的速度;ac;53.2%。
;故答案为:控制滴加混酸的速度;ac;53.2%。
⑷①取10.00 mL稀释液的过程中,酸式滴定管的初始液面为0.20 mL,则量取液体最终的刻度应为10.20 mL,所以量取过程中眼睛要注视酸式滴定管内液面是否达到10.20 mL的刻度,其操作为平视10.20 mL的刻度线;故答案为:平视10.20 mL的刻度线。
②滤渣表面可能有的杂质为氯离子,所以可以通过检验是否有氯离子来确定是否洗涤干净,其操作为取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净;故答案为:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净。
③V mL,0.1000molL-1NaOH溶液中NaOH的物质的量为V×10-4 mol,所以原样品中混酸中氢离子的总物质的量为![]() ,而混酸中硫酸的物质的量为
,而混酸中硫酸的物质的量为![]() ,所以混酸中HNO3的物质的量为
,所以混酸中HNO3的物质的量为![]() ,则HNO3的浓度为
,则HNO3的浓度为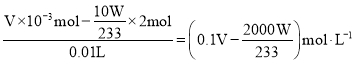 ;故答案为:
;故答案为:![]() 。
。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
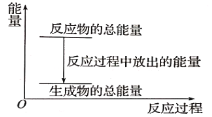
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) △H=-a kJ·mol-1已知:下列说法正确的是( )
2HI(g) △H=-a kJ·mol-1已知:下列说法正确的是( )

A.H2、I2和HI分子中的化学键都是非极性共价键
B.相同条件下,1 mol H2(g)和1 mol I2(g)的总能量小于2 mol HI(g)的总能量
C.断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。某热再生浓差电池工作原理如图所示,通入NH3时电池开始工作,左侧电极质量减少,右侧电极质量增加,中间A为阴离子交换膜,放电后可利用废热进行充电再生。已知:Cu2++4NH3![]()
![]() ,下列说法不正确的是
,下列说法不正确的是
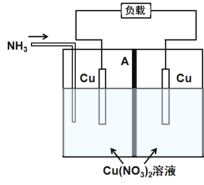
A.放电时,左侧电极发生氧化反应:Cu+4NH3-2e=![]()
B.放电时,电池的总反应为Cu2++4NH3![]()
![]() ,ΔH>0
,ΔH>0
C.放电时,![]() 经离子交换膜由右侧向左侧迁移
经离子交换膜由右侧向左侧迁移
D.上述原电池的形成说明,相同条件下,![]() 的氧化性比Cu2+的氧化性弱
的氧化性比Cu2+的氧化性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
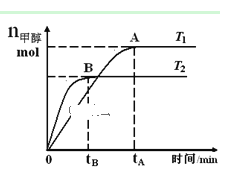
A.平衡常数K =![]()
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的原理示意图如图。下列说法正确的是
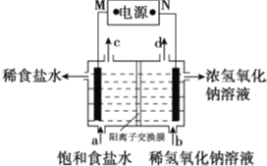
A. M为负极
B. 通电使氯化钠发生电离
C. 出口c收集到的物质是氯气
D. 通电一段时间后,阴极区pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种重要的金属元素,具有多种价态,单质铬是硬度最大的金属,熔点为![]() 。回答下列问题:
。回答下列问题:
![]() 工业上以铬铁矿
工业上以铬铁矿![]() 主要成分是
主要成分是![]() 为原料冶炼铬的流程如图所示:
为原料冶炼铬的流程如图所示:
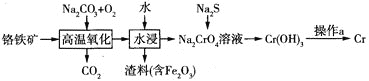
![]() 中铬元素的化合价为_________。
中铬元素的化合价为_________。
![]() 高温氧化时发生反应的化学方程式为________________。
高温氧化时发生反应的化学方程式为________________。
![]() 操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
![]() 是两性氢氧化物,请写出其电离方程式_________________。
是两性氢氧化物,请写出其电离方程式_________________。
![]() 铬元素能形成含氧酸及含氧酸盐,若测得浓度为
铬元素能形成含氧酸及含氧酸盐,若测得浓度为![]() 的铬酸
的铬酸![]() 溶液中含铬元素的微粒浓度分别为
溶液中含铬元素的微粒浓度分别为![]() 、
、![]() 、
、![]() ,试推测
,试推测![]() 溶液呈________
溶液呈________![]() 填“酸”“碱”或“中”
填“酸”“碱”或“中”![]() 性,原因是______________。
性,原因是______________。
![]() 水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
![]() 电解处理含有
电解处理含有![]() 的污水:用铁作电极电解污水,
的污水:用铁作电极电解污水,![]() 被阳极区生成的离子还原成
被阳极区生成的离子还原成![]() ,生成的
,生成的![]() 与阴极区生成的
与阴极区生成的![]() 结合生成
结合生成![]() 沉淀而除去。则阴极上的电极反应式为_______,若要处理
沉淀而除去。则阴极上的电极反应式为_______,若要处理![]() 浓度为
浓度为![]() 的污水,理论上需要消耗_______kg的铁。
的污水,理论上需要消耗_______kg的铁。
![]() 转化为有价值的产品磁性铁铬氧体
转化为有价值的产品磁性铁铬氧体![]() :先向含
:先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气![]() 氧化部分
氧化部分![]() 并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被
在酸性条件下被![]() 还原为
还原为![]() 的离子方程式__________,若处理含
的离子方程式__________,若处理含![]() 不考虑其他含铬微粒
不考虑其他含铬微粒![]() 的污水时恰好消耗
的污水时恰好消耗![]() ,则当铁铬氧体中
,则当铁铬氧体中![]() 时,铁铬氧体的化学式为_______________。
时,铁铬氧体的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芯片主要由单晶体硅成。下图是硅及其化合物的类价二维图,根据要求完成下列化学方程式或离子方程式。

(1)利用焦炭在电炉中还原二氧化硅的化学方程式为_______________。
(2)利用氢氟酸刻蚀玻璃的化学方程式为_______________。
(3)硅酸钠转化为原硅酸的离子方程式_______________。
(4)二氧化硅与烧碱溶液反应的化学方程式_______________。
(5)石英与纯碱在玻璃熔炉里加强热发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图1为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔的石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。
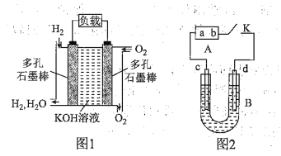
回答下列问题:
![]() 图1中通过负载的电子流动方向为________
图1中通过负载的电子流动方向为________![]() 填“向左”或“向右”
填“向左”或“向右”![]() 。
。
![]() 写出氢氧燃料电池工作时的电极反应式:正极:________,负极:________。
写出氢氧燃料电池工作时的电极反应式:正极:________,负极:________。
以该燃料电池为电源进行实验,如图2所示,B为电解槽,c、d为铁电极,B中装有一定浓度的NaOH溶液,闭合K,c电极周围逐渐析出白色沉淀。
![]() 极是电池的________
极是电池的________![]() 填“正极”或“负极”
填“正极”或“负极”![]() ,c电极的电极反应式为________。
,c电极的电极反应式为________。
![]() 若c、d为石墨电极,B中装有
若c、d为石墨电极,B中装有![]() 和
和![]() 的混合溶液,其中
的混合溶液,其中![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 的物质的量浓度为
的物质的量浓度为![]() 。闭合K,c电极收集到标准状况下
。闭合K,c电极收集到标准状况下![]() 的一种气体甲。在收集气体甲的过程中电解明显分为两个阶段,请写出相应的电解总化学方程式:第一阶段:________ ;第二阶段:________;d电板理论上收集到的气体体积是________
的一种气体甲。在收集气体甲的过程中电解明显分为两个阶段,请写出相应的电解总化学方程式:第一阶段:________ ;第二阶段:________;d电板理论上收集到的气体体积是________![]() 标准状况下
标准状况下![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com