
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

回答下列问题:
![]() 中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为_______。
时锌浸出率最高的原因为_______。

![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
![]() “滤渣3”的主要成分为_______。
“滤渣3”的主要成分为_______。
![]() “电解”时
“电解”时![]() 在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的
在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,该气体是_______
溶液中,无明显现象,该气体是_______![]() 写化学式
写化学式![]() 。电解后的电解液经补充_______
。电解后的电解液经补充_______![]() 写一种物质的化学式
写一种物质的化学式![]() 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
【答案】![]()
![]() 低于
低于![]() 时,浸出反应速率随温度的升高而增大;超过
时,浸出反应速率随温度的升高而增大;超过![]() 时,氨气逸出导致浸出反应速率下降
时,氨气逸出导致浸出反应速率下降 ![]() 胶体
胶体![]()
![]() 、Cd
、Cd ![]() 或
或![]()
![]()
![]() 或
或![]()
【解析】
由流程可知, 氧化锌烟灰加入氨水、氯化铵进行溶浸,溶浸后氧化锌烟灰中锌、铜、
、镉、砷元素分别以以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在,加入过氧化氢,
的形式存在,加入过氧化氢,![]() 转化为As2O5,胶体吸附聚沉除去,过滤后加入锌粉还原,可除去Cu、Cd等,滤液主要含有Zn(NH3)42+, 电解可生成高纯度锌,以此解答该题。
转化为As2O5,胶体吸附聚沉除去,过滤后加入锌粉还原,可除去Cu、Cd等,滤液主要含有Zn(NH3)42+, 电解可生成高纯度锌,以此解答该题。
![]() 中Zn的化合价为
中Zn的化合价为![]() ;依据流程图可知,“溶浸”中ZnO发生反应的离子方程式为:
;依据流程图可知,“溶浸”中ZnO发生反应的离子方程式为:![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为:低于
时锌浸出率最高的原因为:低于![]() 时,浸出反应速率随温度的升高而增大;超过
时,浸出反应速率随温度的升高而增大;超过![]() 时,氨气逸出导致浸出反应速率下降;
时,氨气逸出导致浸出反应速率下降;
故答案为:低于时,浸出反应速率随温度的升高而增大;超过
![]() 时,氨气逸出导致浸出反应速率下降;
时,氨气逸出导致浸出反应速率下降;
![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为:
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为:![]() 胶体
胶体![]() ;
;
故答案为:![]() 胶体
胶体![]() ;
;
![]() 依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物,所以主要成分为:Cu、Cd;故答案为:Cu、Cd;
依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物,所以主要成分为:Cu、Cd;故答案为:Cu、Cd;
![]() “电解”时
“电解”时![]() 在阴极发生还原反应,所以电极反应式为:
在阴极发生还原反应,所以电极反应式为:![]() 或
或![]() ;阳极发生氧化反应,放出一种无色无味的气体,将其通入滴有KSCN的
;阳极发生氧化反应,放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,所以该气体是
溶液中,无明显现象,所以该气体是![]() ;依据反应的总方程式可得,电解后的电解液经补充
;依据反应的总方程式可得,电解后的电解液经补充![]() 或
或![]() 后可返回“溶浸”工序继续使用。故答案为:
后可返回“溶浸”工序继续使用。故答案为:![]() 或
或![]() ;
;![]() ;
;![]() 或
或![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。某热再生浓差电池工作原理如图所示,通入NH3时电池开始工作,左侧电极质量减少,右侧电极质量增加,中间A为阴离子交换膜,放电后可利用废热进行充电再生。已知:Cu2++4NH3![]()
![]() ,下列说法不正确的是
,下列说法不正确的是
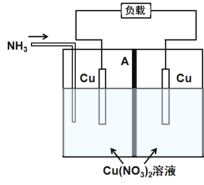
A.放电时,左侧电极发生氧化反应:Cu+4NH3-2e=![]()
B.放电时,电池的总反应为Cu2++4NH3![]()
![]() ,ΔH>0
,ΔH>0
C.放电时,![]() 经离子交换膜由右侧向左侧迁移
经离子交换膜由右侧向左侧迁移
D.上述原电池的形成说明,相同条件下,![]() 的氧化性比Cu2+的氧化性弱
的氧化性比Cu2+的氧化性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芯片主要由单晶体硅成。下图是硅及其化合物的类价二维图,根据要求完成下列化学方程式或离子方程式。

(1)利用焦炭在电炉中还原二氧化硅的化学方程式为_______________。
(2)利用氢氟酸刻蚀玻璃的化学方程式为_______________。
(3)硅酸钠转化为原硅酸的离子方程式_______________。
(4)二氧化硅与烧碱溶液反应的化学方程式_______________。
(5)石英与纯碱在玻璃熔炉里加强热发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120 ℃时,以任意质量比混合的某烃的混合物和过量 O2 在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是( )
A.CH4和C2H4B.CH4和C2H6C.C2H4和C2H6D.C2H2和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,![]() 某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为
某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为![]() ;若用足量碱石灰吸收燃烧产物,则碱石灰增重
;若用足量碱石灰吸收燃烧产物,则碱石灰增重![]() 。
。
(1)计算燃烧产物中水的质量_____________。
(2)若原气体是单一气体,通过计算推断它的分子式___________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式________________(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。
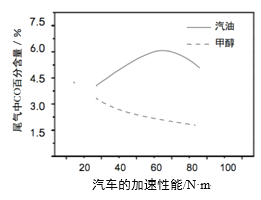
根据图信息分析,与汽油相比,甲醇作为燃料的优点是______。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入______。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______(填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
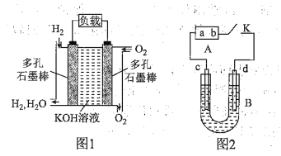
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图1为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔的石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。
回答下列问题:
![]() 图1中通过负载的电子流动方向为________
图1中通过负载的电子流动方向为________![]() 填“向左”或“向右”
填“向左”或“向右”![]() 。
。
![]() 写出氢氧燃料电池工作时的电极反应式:正极:________,负极:________。
写出氢氧燃料电池工作时的电极反应式:正极:________,负极:________。
以该燃料电池为电源进行实验,如图2所示,B为电解槽,c、d为铁电极,B中装有一定浓度的NaOH溶液,闭合K,c电极周围逐渐析出白色沉淀。
![]() 极是电池的________
极是电池的________![]() 填“正极”或“负极”
填“正极”或“负极”![]() ,c电极的电极反应式为________。
,c电极的电极反应式为________。
![]() 若c、d为石墨电极,B中装有
若c、d为石墨电极,B中装有![]() 和
和![]() 的混合溶液,其中
的混合溶液,其中![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 的物质的量浓度为
的物质的量浓度为![]() 。闭合K,c电极收集到标准状况下
。闭合K,c电极收集到标准状况下![]() 的一种气体甲。在收集气体甲的过程中电解明显分为两个阶段,请写出相应的电解总化学方程式:第一阶段:________ ;第二阶段:________;d电板理论上收集到的气体体积是________
的一种气体甲。在收集气体甲的过程中电解明显分为两个阶段,请写出相应的电解总化学方程式:第一阶段:________ ;第二阶段:________;d电板理论上收集到的气体体积是________![]() 标准状况下
标准状况下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用![]() 与
与![]() 制取
制取![]() 气体,再由
气体,再由![]() 在强碱性条件下与过量的
在强碱性条件下与过量的![]() 反应制得漂白剂
反应制得漂白剂![]() 装置如图1所示
装置如图1所示![]() .
.
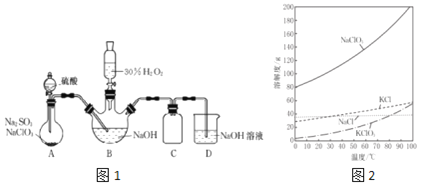
已知![]() 如图
如图![]() :
:![]() 饱和溶液在温度低于
饱和溶液在温度低于![]() 时析出的晶体是
时析出的晶体是![]() ,高于
,高于![]() 时析出晶体是
时析出晶体是![]() ;
;![]() Ⅱ
Ⅱ![]()
![]() 超过
超过![]() 时会完全分解;
时会完全分解;![]() Ⅲ
Ⅲ![]() 高于
高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
![]() 图1装置A发生的反应中,还原剂是______.
图1装置A发生的反应中,还原剂是______.
![]() 图1装置B中反应生成
图1装置B中反应生成![]() 的化学方程式为______.
的化学方程式为______.
![]() 实验中图1装置B需进行温度控制不超过
实验中图1装置B需进行温度控制不超过![]() ,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有______、______.
,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有______、______.
![]() 请补充从图1装置B反应后的溶液中获得
请补充从图1装置B反应后的溶液中获得![]() 晶体的操作步骤.
晶体的操作步骤.
![]() 在
在![]() 时蒸发结晶;
时蒸发结晶;![]() ______;
______;![]() ______;
______;![]() ______;得到成品.
______;得到成品.
![]() 图1装置C的作用是______.
图1装置C的作用是______.
![]() 证明实验后图1装置B所得混合溶液中的
证明实验后图1装置B所得混合溶液中的![]() 具有氧化性的实验方案是______
具有氧化性的实验方案是______![]() 可供选用的试剂:稀
可供选用的试剂:稀![]() 、
、![]() 溶液、KSCN溶液
溶液、KSCN溶液![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑤五种元素在元素周期表中的位置如下图所示:
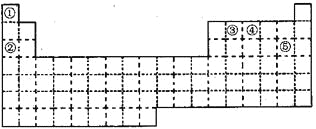
回答下列问题:
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是___________;
(2)②③④元素原子中,半径最小的是_________(填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是_____(化学式)。该化合物中,化学键的类型为_________(选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元素④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是________(化学式);
(5)元素⑤单质与水反应的离子方程式:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com