
【题目】某课外活动小组设计了以下实验测定Cu—Ag合金与浓硝酸的反应。其实验装置如图:

请回答下列问题:
(1)F仪器的名称是_______________,作用是____________________________。
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为____________________________;装置A中盛放的是酸性高锰酸钾溶液,作用是___________________________________________。
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后__________(填操作步骤),再将B装置分液漏斗中的浓硝酸缓慢滴加到三颈烧瓶中。
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
滴定前体积/mL | 滴定后体积/mL | |
笫一次 | 0.33 | 20.32 |
笫二次 | 1.25 | 23.26 |
笫=.次 | 1.47 | 21.48 |
装置D中生成的硝酸为________mol,则Cu-Ag合金与浓硝酸反应过程中生成的NO2在标准状况下的体积为__________mL。
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积_________(填“偏大”或“偏小”),此时应将量气筒的位置_______(填“下移”或“上移”),以保证量气筒中的液面与干燥管中的液面持平。
【答案】 (直形)冷凝管 冷却回流,防止硝酸挥发出来 NH4Cl+NaNO3![]() NaCl+N2↑+2H2O 除去N2中含有的还原性物质 打开K1和K2,关闭K3,向装置中通入N2,直至排出装置中的空气为止 0.02 672 偏小 下移
NaCl+N2↑+2H2O 除去N2中含有的还原性物质 打开K1和K2,关闭K3,向装置中通入N2,直至排出装置中的空气为止 0.02 672 偏小 下移
【解析】(1)F仪器的名称是直形冷凝管,作用是冷却回流,防止硝酸挥发出来;(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,同时生成氯化钠和水,该反应的化学方程式为NH4Cl+NaNO3![]() NaCl+N2↑+2H2O;装置A中盛放的是酸性高锰酸钾溶液,作用是除去N2中含有的还原性物质;(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后打开K1和K2,关闭K3,向装置中通入N2,直至排出装置中的空气为止,再将B装置分液漏斗中的浓硝酸缓慢滴加到颈烧瓶中;(4)三次滴定消耗的氢氧化钠的体积分别为19.99mL、22.01mL、20.01mL,第二次误较大舍去,求平均值为20.00mL,则装置D中生成的硝酸浓度为
NaCl+N2↑+2H2O;装置A中盛放的是酸性高锰酸钾溶液,作用是除去N2中含有的还原性物质;(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后打开K1和K2,关闭K3,向装置中通入N2,直至排出装置中的空气为止,再将B装置分液漏斗中的浓硝酸缓慢滴加到颈烧瓶中;(4)三次滴定消耗的氢氧化钠的体积分别为19.99mL、22.01mL、20.01mL,第二次误较大舍去,求平均值为20.00mL,则装置D中生成的硝酸浓度为![]() =0.04mol/L,物质的量为0.04mol/L×0.5L=0.02mol;根据反应3NO2+H2O=2HNO3+NO,n(NO2)=
=0.04mol/L,物质的量为0.04mol/L×0.5L=0.02mol;根据反应3NO2+H2O=2HNO3+NO,n(NO2)= ![]() n(HNO3)=
n(HNO3)= ![]() 0.02mol=0.03mol,V(NO2)= 0.03mol
0.02mol=0.03mol,V(NO2)= 0.03mol![]() 22.4mol/L=0.672L=672mL;(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,则外压比内压大,直接读数会使测定的气体体积小,此时应将量气筒的位置下移,以保证量气筒中的液面与干燥管中的液面持平。
22.4mol/L=0.672L=672mL;(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,则外压比内压大,直接读数会使测定的气体体积小,此时应将量气筒的位置下移,以保证量气筒中的液面与干燥管中的液面持平。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】分子式为C7H16、C5H11Cl、C5H10(链状,不考虑空间构型)的同分异构体的数目分别有( )种
A. 9,8,5 B. 8,9,5 C. 9,9,6 D. 8,8,6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1Na2S2O3溶液润洗,然后装入0.01mol·L-1Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________;
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.c(H+)>c(HC2O4-)>c[HCO3-)>c[CO32-) B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(6)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:请根据以下信息回答下列问题:
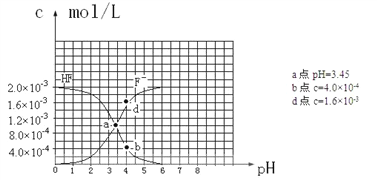
①25℃时,HF电离平衡常数的数值Ka≈_______________________________。
②4.0×10-3 mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1 L 浓度为1 mol·L-1食盐水中。下列说法正确的是( )
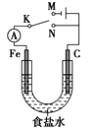
A. 若电键K与N连接,铁被保护不会腐蚀
B. 若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C. 若电键K与M连接,将石墨棒换成铝片,可实现铁棒上镀铝
D. 若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: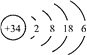 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 该元素处于第四周期第ⅥA族 B. SeO2既有氧化性又有还原性
C. 该原子的质量数为34 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理酸性含铬废水(主要含有Cr2O![]() )时,以铁板作阴、阳极,处理过程中存在反应Cr2O
)时,以铁板作阴、阳极,处理过程中存在反应Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
A. 阳极反应为Fe-2e-===Fe2+
B. 电解过程中溶液pH不会变化
C. 处理过程中有Fe(OH)3沉淀生成
D. 每转移12 mol电子,有1 mol Cr2O![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com