
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
【答案】C
【解析】分析:A项,光合作用消耗CO2;B项,自然降雨时H2O会与少量CO2反应生成H2CO3,不会引起CO2含量的上升;C项,化石燃料指煤、石油、天然气,煤、石油、天然气中都含C元素,燃烧后生成CO2;D项,碳酸盐沉积指由形成于海洋或湖泊底部的粒装泥状碳酸盐矿物及其集合体,通过生物作用或从过饱和碳酸盐的水体中直接沉淀,水体中生物活动消耗CO2,有利于碳酸盐沉积。
详解:A项,光合作用消耗CO2,光合作用的总方程式可表示为6CO2+6H2O![]() C6H12O6+6O2,光合作用会引起大气中CO2含量下降;B项,自然降雨时H2O会与少量CO2反应生成H2CO3,不会引起CO2含量的上升;C项,化石燃料指煤、石油、天然气,煤、石油、天然气中都含C元素,C元素燃烧后生成CO2,化石燃料的燃烧会引起大气中CO2含量上升;D项,碳酸盐沉积指由形成于海洋或湖泊底部的粒装泥状碳酸盐矿物及其集合体,通过生物作用或从过饱和碳酸盐的水体中直接沉淀,水体中生物活动消耗CO2,有利于碳酸盐沉积,碳酸盐沉积不会引起大气中CO2含量上升;化石燃料的燃烧会引起大气中CO2含量上升,答案选C。
C6H12O6+6O2,光合作用会引起大气中CO2含量下降;B项,自然降雨时H2O会与少量CO2反应生成H2CO3,不会引起CO2含量的上升;C项,化石燃料指煤、石油、天然气,煤、石油、天然气中都含C元素,C元素燃烧后生成CO2,化石燃料的燃烧会引起大气中CO2含量上升;D项,碳酸盐沉积指由形成于海洋或湖泊底部的粒装泥状碳酸盐矿物及其集合体,通过生物作用或从过饱和碳酸盐的水体中直接沉淀,水体中生物活动消耗CO2,有利于碳酸盐沉积,碳酸盐沉积不会引起大气中CO2含量上升;化石燃料的燃烧会引起大气中CO2含量上升,答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了以下实验测定Cu—Ag合金与浓硝酸的反应。其实验装置如图:

请回答下列问题:
(1)F仪器的名称是_______________,作用是____________________________。
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为____________________________;装置A中盛放的是酸性高锰酸钾溶液,作用是___________________________________________。
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后__________(填操作步骤),再将B装置分液漏斗中的浓硝酸缓慢滴加到三颈烧瓶中。
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
滴定前体积/mL | 滴定后体积/mL | |
笫一次 | 0.33 | 20.32 |
笫二次 | 1.25 | 23.26 |
笫=.次 | 1.47 | 21.48 |
装置D中生成的硝酸为________mol,则Cu-Ag合金与浓硝酸反应过程中生成的NO2在标准状况下的体积为__________mL。
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积_________(填“偏大”或“偏小”),此时应将量气筒的位置_______(填“下移”或“上移”),以保证量气筒中的液面与干燥管中的液面持平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 金刚石晶体中的最小碳环由6个碳原子构成
B. Na2O2晶体中阴离子与阳离子数目之比为1:1
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. Na2O2晶体中的阳离子与阴离子个数比为1:1
B. 石墨晶体中C原子数与C—C共价键数比为1:3
C. 3HO与2HO分子中的质子个数比为1:1
D. 冰晶体中H2O分子个数与氢键数目比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
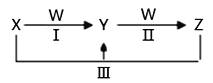
(1)若X是烧碱,Z是小苏打。
① W的分子式是____________________。
② 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
(2)若X是氯气、Z是氯化亚铁。
① 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
② Y可作净水剂,其原理是_________________________(用离子方程式表示)。在使用时发现Y不能使酸性废水中的悬浮物沉降除去,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
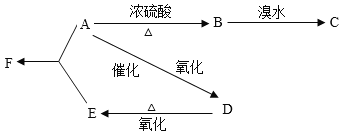
【题目】某有机物A由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、D。已知B的产量通常用来衡量一个国家的石油化工水平,转变关系如下:
(已知: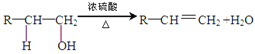 、
、![]() )
)
(1)写出A、B、C、D、E、F的结构简式:A:_______,B:________,C:__________,D:____________,E:____________,F:____________。
(2)写出实现下列转化的化学方程式,并注明反应类型:
A→B___________________________________________________________________;
B→C___________________________________________________________________;
A→D___________________________________________________________________;
A+E→F_________________________________________________________________;
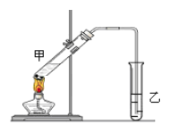
(3)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为____________,该溶液的主要作用是____________;该装置图中有一个明显的错误是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含+6价的铬会损害环境,必须进行处理。某工厂的处理工艺流程如下:

(1)N2H4的电子式为_____。
(2)下列溶液中,可替代N2H4的是_____。(填选项序号字母)
a.FeSO4溶液 b.浓HNO3溶液 c.酸性KMnO4溶液 d.Na2SO3溶液
(3)已知加入N2H4后,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为_____。
(4)在实际工业生产中,处理含铬废水还可采用直接沉淀的方法,其成本较低。
①已知酸性废水中存在Cr2O72-和CrO42-的转化平衡,请用离子方程式表示它们之间的转化反应_____;
②加入沉淀剂BaCl2溶液之前需加入一定量的NaOH溶液,以利于沉淀的生成,则生成的沉淀为_____(写化学式)。
(5)工业上还可用电解法来处理含Cr2O72-的酸性废水,通过电解制得还原剂。右图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是_____(填“铁”或“石墨”)。
②该处理过程中,Cr2O72-被还原成Cr3+的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com