
【题目】下列说法中正确的是( )
A. 金刚石晶体中的最小碳环由6个碳原子构成
B. Na2O2晶体中阴离子与阳离子数目之比为1:1
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,在高温下也不会和O2反应
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1Na2S2O3溶液润洗,然后装入0.01mol·L-1Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________;
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.c(H+)>c(HC2O4-)>c[HCO3-)>c[CO32-) B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(6)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:请根据以下信息回答下列问题:
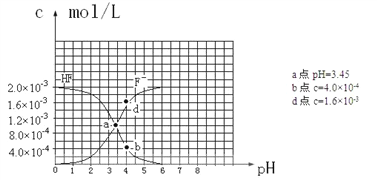
①25℃时,HF电离平衡常数的数值Ka≈_______________________________。
②4.0×10-3 mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理酸性含铬废水(主要含有Cr2O![]() )时,以铁板作阴、阳极,处理过程中存在反应Cr2O
)时,以铁板作阴、阳极,处理过程中存在反应Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
A. 阳极反应为Fe-2e-===Fe2+
B. 电解过程中溶液pH不会变化
C. 处理过程中有Fe(OH)3沉淀生成
D. 每转移12 mol电子,有1 mol Cr2O![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是元素周期表的一部分:
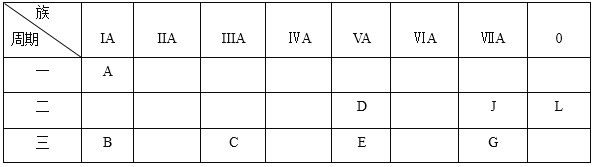
根据以上元素在周期表中的位置,用化学式填写空白。
(1)非金属性最强的元素是_________;化学性质最不活泼的是_________;除L外,原子半径最大的是_________;A与D形成的10电子离子是_________。
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式排列成序是__________________;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式_________,_________。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在_________条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com