
【题目】下列是元素周期表的一部分:
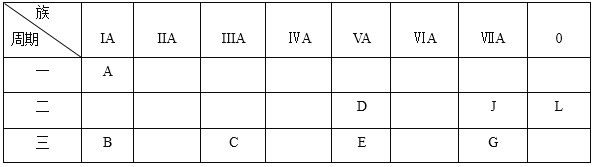
根据以上元素在周期表中的位置,用化学式填写空白。
(1)非金属性最强的元素是_________;化学性质最不活泼的是_________;除L外,原子半径最大的是_________;A与D形成的10电子离子是_________。
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式排列成序是__________________;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式_________,_________。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________。
【答案】 F Ne Na NH4+ (NH2-) NaOH Al(OH)3 H3PO4 HNO3 Na+ ![]() Na+ Na+
Na+ Na+![]() Na+ Cl->F->Na+>Al3+
Na+ Cl->F->Na+>Al3+
【解析】由周期表可知,ABCDEJGL分别为:H、Na、Al、N、P、F、Cl、Ne。
(1)元素周期表中,除0族元素外,右上角元素的非金属性最强,故非金属性最强的元素是F;Ne位于0族,最外层电子数为8,属于惰性气体,化学性质最不活泼;同周期元素随原子序数的增加原子半径逐渐减小,同主族元素随原子序数的增加原子半径逐渐增大,所以原子半径最大的是Na;A与D形成的阳离子是铵根离子化学式为NH4+或阴离子NH2-;
(2)B、C、D、E四种元素的最高价氧化物对应水化物的化学式为:NaOH、Al(OH)3 、HNO3、H3PO4 按碱性逐渐减弱、酸性逐渐增强的顺序为:NaOH、Al(OH)3、H3PO4、HNO3。,
同周期元素随原子序数的增加,其最高价氧化物对应的水化物的碱性逐渐减弱,酸性增强;同主族元素随原子序数的增加,其最高价氧化物对应的水化物的碱性逐渐增强,酸性减弱;
(3)B元素可以形成两种氧化物分别是氧化钠和过氧化钠,两者均为离子化合物,其电子式为Na+![]() Na+、Na+
Na+、Na+ ![]() Na+ ;
Na+ ;
(4)B、C、G、J四种元素分别为Na、Al、Cl、 F,形成的粒子分别为Na+、Al3+、Cl-、F-,粒子半径大小比较的一般规则为电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,所以粒子半径大小排序为Cl->F->Na+>Al3+。


科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液490mL。实验室提供以下仪器:①烧杯 ②100 mL量筒 ③药匙 ④玻璃棒 ⑤托盘天平(带砝码)。请回答下列问题:
(1)计算结果:需要称取NaOH固体的质量为____________;
(2)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是 _______________、______________。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________、后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_______________;
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度T1时,Ag2SO4在水中的沉淀溶解曲线如图实线所示。下列说法正确的是( )

A. T1时,Ag2SO4的溶度积常数(Ksp)为1×10-3
B. T1时,0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀
C. b点表示T1时Ag2SO4的饱和溶液,稀释时可以使溶液由b点变到a点
D. 仅通过降温的方法,可以使T2时的饱和溶液从c点变到T1时b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g) +2Y(g)![]() 3Z(g)△H=-a kJmol﹣1(a>0)。下列说法不正确的是( )
3Z(g)△H=-a kJmol﹣1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 1molX和2molY完全反应生成3mol的Z,放出aKJ的热量
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 金刚石晶体中的最小碳环由6个碳原子构成
B. Na2O2晶体中阴离子与阳离子数目之比为1:1
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. Na2O2晶体中的阳离子与阴离子个数比为1:1
B. 石墨晶体中C原子数与C—C共价键数比为1:3
C. 3HO与2HO分子中的质子个数比为1:1
D. 冰晶体中H2O分子个数与氢键数目比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
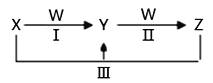
(1)若X是烧碱,Z是小苏打。
① W的分子式是____________________。
② 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
(2)若X是氯气、Z是氯化亚铁。
① 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
② Y可作净水剂,其原理是_________________________(用离子方程式表示)。在使用时发现Y不能使酸性废水中的悬浮物沉降除去,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com