
【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
【答案】 ① 放热 -92kJ C5H12 C10H16
【解析】(1)根据反应的特点和能量变化分析解答;
(2)根据反应物总能量与生成物总能量的关系判断是放热还是吸热;反应热等于断键吸收的能量和形成化学键所放出的能量的差值;
(3)根据烷烃的通式解答;
(4)将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式。
(1)①煅烧石灰石制生石灰是吸热反应;②燃烧木炭取暖是放热反应;③酸碱中和反应是放热反应;④铝粉与氧化铁粉末在高温下发生铝热反应是放热反应;⑤生石灰与水作用制熟石灰是放热反应;⑥食物因氧化而腐败的放热反应。则属于吸热反应的是①;
(2)①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,这说明反应物的总能量高于生成物的总能量,因此该反应为放热反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g)的反应热△H=(946+3×436-2×3×391)kJ/mol=-92kJ/mol,因此1molN2完全反应生成NH3会放出92kJ的热量。
2NH3(g)的反应热△H=(946+3×436-2×3×391)kJ/mol=-92kJ/mol,因此1molN2完全反应生成NH3会放出92kJ的热量。
(3)烷烃的通式是CnH2n+2,相对分子质量为72的烷烃,则14n+2=72,解得n=5,所以分子式为C5H12。
(4)苧烯的键线式如图![]() ,则苧烯的分子式为C10H16。
,则苧烯的分子式为C10H16。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 金刚石晶体中的最小碳环由6个碳原子构成
B. Na2O2晶体中阴离子与阳离子数目之比为1:1
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、D。已知B的产量通常用来衡量一个国家的石油化工水平,转变关系如下:
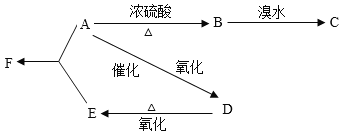
(已知: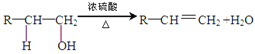 、
、![]() )
)
(1)写出A、B、C、D、E、F的结构简式:A:_______,B:________,C:__________,D:____________,E:____________,F:____________。
(2)写出实现下列转化的化学方程式,并注明反应类型:
A→B___________________________________________________________________;
B→C___________________________________________________________________;
A→D___________________________________________________________________;
A+E→F_________________________________________________________________;
(3)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为____________,该溶液的主要作用是____________;该装置图中有一个明显的错误是_______________________________。
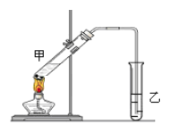
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KNO3溶液中含杂质KCl和Ca(NO3)2 , 现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.AgNO3、K2CO3
B.AgNO3、K2CO3、HNO3
C.K2CO3、AgNO3
D.K2CO3、AgNO3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含+6价的铬会损害环境,必须进行处理。某工厂的处理工艺流程如下:

(1)N2H4的电子式为_____。
(2)下列溶液中,可替代N2H4的是_____。(填选项序号字母)
a.FeSO4溶液 b.浓HNO3溶液 c.酸性KMnO4溶液 d.Na2SO3溶液
(3)已知加入N2H4后,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为_____。
(4)在实际工业生产中,处理含铬废水还可采用直接沉淀的方法,其成本较低。
①已知酸性废水中存在Cr2O72-和CrO42-的转化平衡,请用离子方程式表示它们之间的转化反应_____;
②加入沉淀剂BaCl2溶液之前需加入一定量的NaOH溶液,以利于沉淀的生成,则生成的沉淀为_____(写化学式)。
(5)工业上还可用电解法来处理含Cr2O72-的酸性废水,通过电解制得还原剂。右图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是_____(填“铁”或“石墨”)。
②该处理过程中,Cr2O72-被还原成Cr3+的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合后的溶液:[Cl-]>[NH4+]> [Na+]>[OH-]>[H+]
B. 等物质的量的NaClO、NaHCO3混合溶液中:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+2[CO32-]
C. pH=2的HA溶液与pH=12的NaOH溶液等体积混合:[M+]=[A-]>[OH-]=[H+]
D. 某二元弱酸的酸式盐NaHA溶液中,[OH-]+[H2A]=[H+]+2[A2-]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com