
【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中导电粒子的数目减少
B. 溶液中![]() 不变
不变
C. 醋酸的电离程度增大,c(H+)亦增大
D. 再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
观点一是:“理论派”认为电解氯化铜溶液后溶液的pH 升高。
观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如下图曲线的关系。
pH与时间关系图
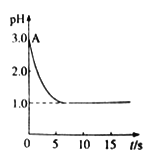
请回答下列问题:
(1)电解前氯化铜溶液的pH处在A 点位置的原因是______________________(用离子方程式说明)。
(2)“理论派”所持观点的理论依据是________________________。
(3) “实验派”实验结论是_________________。他们所述“精确实验”是通过______________确定的。
(4)若“实验派”的观点正确,那么你认为他们所持观点的理由是______________________(用化学方程式和必要的文字加以简述)。
【答案】 Cu2++2H2O![]() Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2
Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2![]() Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
【解析】本题主要考查平衡状态的移动。
(1)电解前氯化铜溶液的pH处在A点位置的原因是Cu2++2H2O![]() Cu(OH)2+2H+。
Cu(OH)2+2H+。
(2)“理论派”所持观点的理论依据是因为Cu2++2e-=Cu,c(Cu2+)减小,使Cu2+水解平衡向左移动,c(H+)减小,pH上升。
(3)“实验派”实验结论是pH降低。他们所述“精确实验”是通过测定溶液pH确定的。
(4)若“实验派”的观点正确,那么他们所持观点的理由是CuCl2![]() Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
【题型】填空题
【结束】
22
【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,1570C时开始分解:
(1)探究草酸的酸性
250C H2C2O4 K1 = 5.4 x 10-2,K2 = 5. 4 x 10 -5 ;H2CO3 K1=4.5x10-7 K2= 4.7X10-11
下列化学方程式可能正确的是________
A. H2C2O4 +CO32-=HCO3- +HC2O4- B. HC2O4- +CO32-= HCO3-+C2O42-
C. 2C2O42-+CO2+H2O=2HC2O4-+CO32- D. H2C2O4 +CO32-=C2O42-+H2O+CO2
(2)探究草酸分解产物
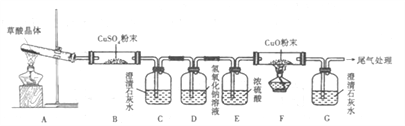
①实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用:_______,证明有CO气体生成的现象是:_____________________
②写出H2C2O4分解的化学方程式_____________________
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加人4mLO.O1mol/T. KMnO4酸性溶液和2mL O.1mol/L H2C2O4溶液, 再向乙试管中加人一粒黄豆大的MnSO4固体,摇匀。填写下表:
反应现象 | ______________ |
实验结论 | ______________ |
试管中发送反应的离子方程式 | ______________ |
(4)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度
实验步骤:准确称取2.OgNa2C2O4固体,配成1OO mL溶液,取出20.OOmL于锥形瓶中=再向瓶 中加人足量稀H2SO4 ,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.OOmL0
①高锰酸钾溶液应装在_______滴定管中。(填“酸 式”或“碱 式”)
②滴定至终点时的实验现象是:______________。
③Na2C2O4的纯度是:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 元素周期表是按照元素相对原子质量大小排列而成的
B. 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C. 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D. 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com