
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】某KNO3溶液中含杂质KCl和Ca(NO3)2 , 现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.AgNO3、K2CO3
B.AgNO3、K2CO3、HNO3
C.K2CO3、AgNO3
D.K2CO3、AgNO3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中注明的方法分离下列各组混合物,其中不正确的是( )
A.氮气和氧气(液化蒸馏)
B.食盐中的沙砾(溶解过滤,蒸发结晶)
C.氢氧化铁胶体中的少量食盐(渗析)
D.除去乙醇中溶解的微量食盐(过滤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应H2+Cl2![]() 2HCl,下列说法正确的是
2HCl,下列说法正确的是
A.该反应涉及到离子键和共价键的断裂与形成
B.该反应中,化学能只转变为热能
C.断开1molH﹣H键和1molCl﹣Cl键所吸收的总能量,小于形成1molH﹣Cl键所放出的能量
D.反应物所具有的总能量高于产物所具有的总能量
[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则下列说法正确的是( )
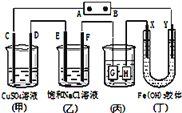
A. 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为:C2H6 -14e-+ 18OH- = 2CO32- + 12H2O
B. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液选是AgNO3溶液
C. (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶体带正电荷
D. C、D、
E. F电极均有单质生成,且其物质的量比为1:2:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铝化合物在生活生产中有广泛应用。
(1)自然界中存在的54Fe和56Fe,它们互称为_____。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因_____。
(3)已知明矾可以净水,明矾化学式_____,试结合离子反应方程式与文字解释明矾净水的原因_____
(4)以NaAlO2溶液、AlCl3溶液、氨水、CO2气体为原料,选择合适试剂,写出实验室制备Al(OH)3的离 子方程式:(任意两条途径)_____、_____
(5)达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐,化学式为Al2Mg6(OH)16CO3·4H2O【可看做2Al(OH)3·5Mg(OH)2·MgCO3·4H2O】。1mol达喜分别与足量的盐酸和 NaOH 溶液反应,消耗盐酸和 NaOH 的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体加热到850℃时,可建立下列平衡:CO2+H2![]() CO+H2O(g),在一定温度下,平衡时有90% H2变成水,且平衡常数K=1,则原混合气体中CO2与H2的分子数比为( )
CO+H2O(g),在一定温度下,平衡时有90% H2变成水,且平衡常数K=1,则原混合气体中CO2与H2的分子数比为( )
A. 1︰1 B. 1︰5 C. 1︰10 D. 9︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com