
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合后的溶液:[Cl-]>[NH4+]> [Na+]>[OH-]>[H+]
B. 等物质的量的NaClO、NaHCO3混合溶液中:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+2[CO32-]
C. pH=2的HA溶液与pH=12的NaOH溶液等体积混合:[M+]=[A-]>[OH-]=[H+]
D. 某二元弱酸的酸式盐NaHA溶液中,[OH-]+[H2A]=[H+]+2[A2-]
【答案】A
【解析】A. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合后,NH4Cl+NaOH![]() NaCl+NH3·H2O,形成等浓度的NaCl、NH4Cl、NH3·H2O的混合溶液,NH3·H2O的电离程度大于NH4Cl的水解程度,所以[Cl-]>[NH4+]>[Na+]>[OH-]>[H+],故A正确;B. 等物质的量的NaClO、NaHCO3混合溶液中,氯元素和碳元素物质的量相等:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+[CO32-],故B错误;C. 若HA为弱酸,弱酸难电离,HA浓度大于NaOH,则中和反应剩余酸,混合溶液呈酸性,故C错误;D. 某二元弱酸的酸式盐NaHA溶液中,电荷守恒:[Na+]+[H+]=[OH-]+[HA-]+2[A2-],元素守恒:[Na+]=[H2A]+[HA-]+[A2-],两个等式消去[Na+]得[H2A]+[H+]=[OH-]+[A2-],故D错误。故选A。
NaCl+NH3·H2O,形成等浓度的NaCl、NH4Cl、NH3·H2O的混合溶液,NH3·H2O的电离程度大于NH4Cl的水解程度,所以[Cl-]>[NH4+]>[Na+]>[OH-]>[H+],故A正确;B. 等物质的量的NaClO、NaHCO3混合溶液中,氯元素和碳元素物质的量相等:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+[CO32-],故B错误;C. 若HA为弱酸,弱酸难电离,HA浓度大于NaOH,则中和反应剩余酸,混合溶液呈酸性,故C错误;D. 某二元弱酸的酸式盐NaHA溶液中,电荷守恒:[Na+]+[H+]=[OH-]+[HA-]+2[A2-],元素守恒:[Na+]=[H2A]+[HA-]+[A2-],两个等式消去[Na+]得[H2A]+[H+]=[OH-]+[A2-],故D错误。故选A。


科目:高中化学 来源: 题型:
【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你回答下列问题:
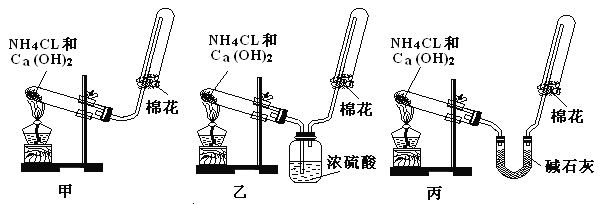
(1)三位同学制取氨气的化学方程式为:___________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是_______ 填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)__________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_______ (填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?_______ (填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,1570C时开始分解:
(1)探究草酸的酸性
250C H2C2O4 K1 = 5.4 x 10-2,K2 = 5. 4 x 10 -5 ;H2CO3 K1=4.5x10-7 K2= 4.7X10-11
下列化学方程式可能正确的是________
A. H2C2O4 +CO32-=HCO3- +HC2O4- B. HC2O4- +CO32-= HCO3-+C2O42-
C. 2C2O42-+CO2+H2O=2HC2O4-+CO32- D. H2C2O4 +CO32-=C2O42-+H2O+CO2
(2)探究草酸分解产物
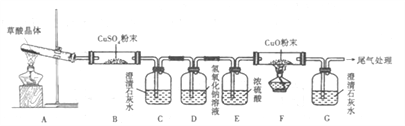
①实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用:_______,证明有CO气体生成的现象是:_____________________
②写出H2C2O4分解的化学方程式_____________________
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加人4mLO.O1mol/T. KMnO4酸性溶液和2mL O.1mol/L H2C2O4溶液, 再向乙试管中加人一粒黄豆大的MnSO4固体,摇匀。填写下表:
反应现象 | ______________ |
实验结论 | ______________ |
试管中发送反应的离子方程式 | ______________ |
(4)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度
实验步骤:准确称取2.OgNa2C2O4固体,配成1OO mL溶液,取出20.OOmL于锥形瓶中=再向瓶 中加人足量稀H2SO4 ,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.OOmL0
①高锰酸钾溶液应装在_______滴定管中。(填“酸 式”或“碱 式”)
②滴定至终点时的实验现象是:______________。
③Na2C2O4的纯度是:______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com