
【题目】下列物质在水中的溶解度比在苯中的溶解度大的是( )
A. NH3 B. CH4 C. C2H4 D. CO2
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】铁是目前应用最多的金属,铁的单质及其化合物用途非常广泛。
(1)K4[Fe(CN)6]可用作食盐的抗结剂。基态钾原子的电子排布式为_______________。
(2)Na2[Fe(CN)5(NO)] 可用作治疗高血压急症。
①Na、N、O的第一电离能有小到大的顺序为_______________。
②CN-中碳原子的杂化类型是_______________。
(3)过氧化氢在FeCl3催化作用下分解生成水和氧气。
①1molH2O2中σ键的数目为_______________。
②H2O的沸点比H2S高的原因是_______________。
(4)铁触媒是重要的催化剂。CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
①与CO互为等电子体的分子为_____________。配合物[Cu(NH3)2]OOCCH3中不存在的的作用力是_______(填字母)。
a.离子键 b.金属键 c.配位键 d.极性共价键
②Fe(CO)5在空气中燃烧的化学方程式为4Fe(CO)5+13O2 ![]() 2Fe2O3+20CO2,Fe2O3的晶体类型是___________。
2Fe2O3+20CO2,Fe2O3的晶体类型是___________。
③铁的晶胞如图所示,若该晶体的密度是ag·cm-3,则两个最近的Fe原子间的距离为_____cm(设NA为阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 金刚石晶体中的最小碳环由6个碳原子构成
B. Na2O2晶体中阴离子与阳离子数目之比为1:1
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
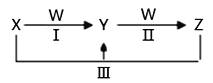
(1)若X是烧碱,Z是小苏打。
① W的分子式是____________________。
② 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
(2)若X是氯气、Z是氯化亚铁。
① 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
② Y可作净水剂,其原理是_________________________(用离子方程式表示)。在使用时发现Y不能使酸性废水中的悬浮物沉降除去,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小
C. pH试纸测得新制氯水的pH为4.5
D. FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、D。已知B的产量通常用来衡量一个国家的石油化工水平,转变关系如下:
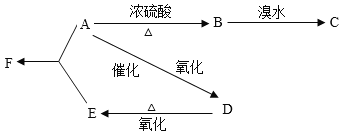
(已知: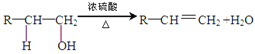 、
、![]() )
)
(1)写出A、B、C、D、E、F的结构简式:A:_______,B:________,C:__________,D:____________,E:____________,F:____________。
(2)写出实现下列转化的化学方程式,并注明反应类型:
A→B___________________________________________________________________;
B→C___________________________________________________________________;
A→D___________________________________________________________________;
A+E→F_________________________________________________________________;
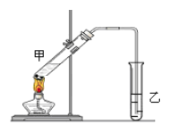
(3)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为____________,该溶液的主要作用是____________;该装置图中有一个明显的错误是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合后的溶液:[Cl-]>[NH4+]> [Na+]>[OH-]>[H+]
B. 等物质的量的NaClO、NaHCO3混合溶液中:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+2[CO32-]
C. pH=2的HA溶液与pH=12的NaOH溶液等体积混合:[M+]=[A-]>[OH-]=[H+]
D. 某二元弱酸的酸式盐NaHA溶液中,[OH-]+[H2A]=[H+]+2[A2-]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com