
����Ŀ������˵���У���ȷ����
A. ��֪25��ʱNH4CNˮ��Һ�Լ��ԣ���25��ʱ�ĵ���ƽ�ⳣ��K(NH3��H2O)>K(HCN)
B. 25��ʱ��Mg(OH)2������20 mL 0.01 mol��L-1��ˮ�е�Ksp����20 mL0.01 mol��L-1NH4Cl��Һ�е�KspС
C. pH��ֽ���������ˮ��pHΪ4.5
D. FeCl3��Һ��Fe2(SO4)3��Һ�������ɡ����ն��õ�Fe2O3
���𰸡�A
�����������������A��NH4CN��Һ�Լ��ԣ�˵��CN����ˮ����������NH4����ˮ�⣬����Խ��Խˮ�⣬�ó�K(NH3��H2O)>K(HCN)����ȷ��B��KSPֻ���¶ȵ�Ӱ�죬�¶Ȳ���KSP���䣬����C�����Ƶ���ˮ�к���HCl��HClO��HClʹpH��ɫ��HClO����ǿ��������ɫ����Ư�ף�������pH���������ˮ��pH������D��FeCl3��ˮ��FeCl3��3H2O![]() Fe(OH)3��3HCl��HCl���Ȼӷ�����ʹƽ�����ƣ������������������������������ȷֽ��Fe2O3����Fe2(SO4)3��6H2O
Fe(OH)3��3HCl��HCl���Ȼӷ�����ʹƽ�����ƣ������������������������������ȷֽ��Fe2O3����Fe2(SO4)3��6H2O![]() 2Fe(OH)3��3H2SO4���������ѻӷ����ᣬ�����������յõ�������������������
2Fe(OH)3��3H2SO4���������ѻӷ����ᣬ�����������յõ�������������������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ���ڻ������в��ܴ��ڵĻ�ѧ���ǣ�������
A.���Ӽ�B.���ۼ�C.���Լ� D.�Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������������������м��㷺��;��
��1����֪��Ӧ����2NH3��g��+CO2��g���TNH2CO2NH4��s����H=��159.5kJ/mol
��Ӧ����NH2CO2NH4��s���TCO��NH2��2 ��s��+H2O��g����H= + 116.5kJ/mol
��Ӧ����H2O��l���TH2O��g����H= + 44.0kJ/mol
��ҵ����CO2��NH3Ϊԭ�Ϻϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽΪ___________________���÷�Ӧ��_________�����¿����Է����У��������������������������κ��¶���������
��2���������Ͽ�֪�������£�K��[Ag��NH3��2+]=1.00��107��Ksp[AgCl]=2.50��10��10��
��������Һ�д���ƽ�⣺Ag+��aq��+2NH3��aq��![]() Ag��NH3��2+ ��aq�����÷�Ӧƽ�ⳣ���ı���ʽΪK��=_______________��
Ag��NH3��2+ ��aq�����÷�Ӧƽ�ⳣ���ı���ʽΪK��=_______________��
�ڼ���õ����淴ӦAgCl ��s��+2NH3��aq��![]() Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��K=_________________________����1LŨ��Ϊ1mol/L��ˮ���������ܽ�AgClΪ_______mol������2λ��Ч���֣���
Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��K=_________________________����1LŨ��Ϊ1mol/L��ˮ���������ܽ�AgClΪ_______mol������2λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ҫ�ò��������ٹ��ˣ������������ܽ⣻��������ƿת��Һ�壩�����в����������ü���Ŀ����ͬ���ǣ� ��
A.�٢�
B.�٢�
C.�٢�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�е��ܽ�ȱ��ڱ��е��ܽ�ȴ����(����)
A. NH3 B. CH4 C. C2H4 D. CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У���ѧ�������ͺͷ��ӵļ���(���Ի�Ǽ���)����ͬ����(����)
A��CO2��SO2 B��CH4��SiO2 C��BF3��NH3 D��HCl��HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ��ȡ�ġ���ˮ��þ����Ҫ�������£�
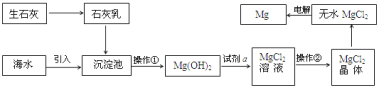
��ʾ�� ��MgCl2����Ļ�ѧʽΪMgCl26H2O��
��MgO���۵�Ϊ2852�棬��ˮMgCl2���۵�Ϊ714�档
��1�������ٵ������� ________�� �����ڵ�����___________����ȴ�ᾧ�����ˡ�
��2���Լ�a��������_____________��
��3�����Ȼ�þ�����������þ�Ļ�ѧ����ʽΪ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ��������������Ķ���������Ԫ����Y�ĵ��ʾ�����Ϊ����������Z��W�γɵ�һ�ֻ��������X��W�γɵĻ����ﷴӦ�����ɵ���ɫ���塣�����ƶ���ȷ����
A. Y������⻯������ȶ��Ա�Z��ǿ
B. ��ͬ����Ԫ���У�W������������Ӧ��ˮ�����������ǿ
C. ���Ӱ뾶��X<Y<Z<W
D. ��W������Һ���ܳʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к��зǼ��Լ���Ϊ�ε���(����)
A. CH3COONa B. NH4Cl C. CaCl2 D. H2O2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com