
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
【答案】D
【解析】Y的单质经常作为保护气,Y为N元素;由Z、W形成的一种化合物可与X、W形成的化合物反应生成淡黄色固体,此反应为SO2+2H2S=3S+2H2O,X、Y、Z、W的原子序数依次增大,X为H元素,Z为O元素,W为S元素。A,非金属性:Y(N)![]() Z(O),最简单氢化物的热稳定性:NH3
Z(O),最简单氢化物的热稳定性:NH3![]() H2O,A项错误;B,W为S,S处于第三周期,第三周期元素中最高价氧化物对应水化物酸性最强的是HClO4,B项错误;C,根据“层多径大,序大径小”,离子半径:X
H2O,A项错误;B,W为S,S处于第三周期,第三周期元素中最高价氧化物对应水化物酸性最强的是HClO4,B项错误;C,根据“层多径大,序大径小”,离子半径:X![]() Z
Z![]() Y
Y![]() W,C项错误;D,含S的盐溶液如Na2S、Na2SO3等溶液呈碱性,Na2SO4等溶液呈中性,NaHSO3溶液等呈酸性,D项正确;答案选D。
W,C项错误;D,含S的盐溶液如Na2S、Na2SO3等溶液呈碱性,Na2SO4等溶液呈中性,NaHSO3溶液等呈酸性,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。
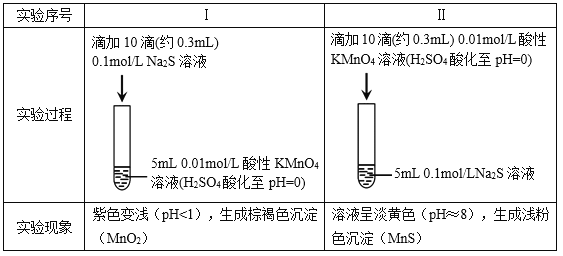
资料:ⅰ. ![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ. 单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有________性。
(2)甲同学预测实验I中S2–被氧化成![]() 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是________。
②乙同学取实验I中少量溶液进行实验,检测到有![]() ,得出S2–被氧化成
,得出S2–被氧化成![]() 的结论,丙同学否定了该结论,理由是________。
的结论,丙同学否定了该结论,理由是________。
③同学们经讨论后,设计了如下实验,证实该条件下![]() 的确可以将S2–氧化成
的确可以将S2–氧化成![]() 。
。
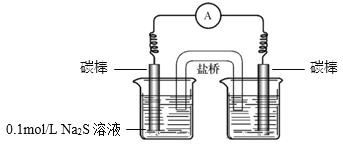
a.右侧烧杯中的溶液是________。
b.连通后电流计指针偏转,一段时间后,________(填操作和现象)。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(![]() )发生反应,该反应的离子方程式是________。
)发生反应,该反应的离子方程式是________。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与________因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小
C. pH试纸测得新制氯水的pH为4.5
D. FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)![]() C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1
②C3H8(g)![]() C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol
③C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
④C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol
(1)计算反应③的反应热△H3=______________。
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
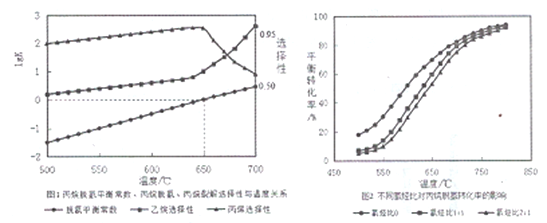
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知: ![]() )
)
(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KNO3溶液中含杂质KCl和Ca(NO3)2 , 现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.AgNO3、K2CO3
B.AgNO3、K2CO3、HNO3
C.K2CO3、AgNO3
D.K2CO3、AgNO3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中所述的两个量,前者一定大于后者的是
A. 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
B. pH=10的NaOH和Ba(OH)2溶液中水的电离程度
C. 物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH4+的物质的量浓度
D. 相同温度下,10mL0.1mol·L-1的醋酸与100mL0.01mo1·L-1的醋酸中H+的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应H2+Cl2![]() 2HCl,下列说法正确的是
2HCl,下列说法正确的是
A.该反应涉及到离子键和共价键的断裂与形成
B.该反应中,化学能只转变为热能
C.断开1molH﹣H键和1molCl﹣Cl键所吸收的总能量,小于形成1molH﹣Cl键所放出的能量
D.反应物所具有的总能量高于产物所具有的总能量
[
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com