
【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)![]() C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1
②C3H8(g)![]() C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol
③C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
④C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol
(1)计算反应③的反应热△H3=______________。
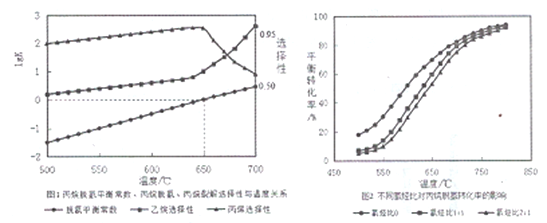
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知: ![]() )
)
(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
【答案】 -136.5kJ/mol > 温度低于600℃,脱氢选择性高,反应速率较慢;温度过高于650℃,反应速率快,但丙烯选择性低,所以选择600-650℃ 41.4%(或0.414) 氢气为脱氢反应的产物之一,原料中氢气浓度的增加会抑制反应的进行( 1.80×10-10 c(R)>c(Na+)>c(H+)>c(OH-)
【解析】(1)反应④—反应②即得反应③,所以△H3=△H4—△H2= -136.5kJ/mol;
(2)根据图象1可知,丙烷脱热闹承认平衡常数随温度的升高而增大,所以△H2>0;工业生产中采用的温度600-650℃,因为温度低于600℃,脱氢选择性高,反应速率较慢;温度过高于650℃,反应速率快,但丙烯选择性低,所以选择600-650℃;
(3)由图象可知在650℃时,C3H8的脱氢平衡常数为1,由反应①C3H8(g)![]() C3H6(g)+ H2(g),设C3H8的脱氢率为x,则平衡时C3H8为(1-x)mol,C3H6 xmol,H2为(1+x)mol,则平衡常数K=
C3H6(g)+ H2(g),设C3H8的脱氢率为x,则平衡时C3H8为(1-x)mol,C3H6 xmol,H2为(1+x)mol,则平衡常数K=![]() =1,则x=0.414或41.4%;
=1,则x=0.414或41.4%;
(4)相同温度下,增大氢烃比,由图象2可知,丙院脱氢平衡转化率是下降的,因为随着氢气量的增加,平衡向左移动,所以丙院脱氢平衡转化率降低;
(5)已知丙烯酸(用HR表示)的电离常数Ka=5.55×10-5,则烯酸钠的水解常数Kh=Kw/Ka =1.0×10-14/5.55×10-5 = 1.80×10-10;将0.2mol/LHR与0.1mol/LNaOH等体积混合后,溶液中的溶质为等浓度的NaR和HR的混合溶液,由于HR的电离常数(Ka=5.55×10-5)大于R—的水解常数(Kh=1.80×10-10),所以溶液呈酸性,则溶液中的离子浓度大小顺序为c(R)>c(Na+)> c(H+) >c(OH-)。


科目:高中化学 来源: 题型:
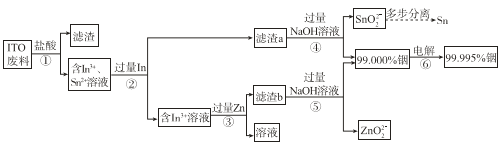
【题目】从废旧液晶显示器的主材 ITO(主要成分是含铟、锡的氧化物)回收铟和锡,流程示意图如下。
资料:
物质 | 铟(In) | 锡(Sn) |
周期表位置 | 第五周期、第IIIA族 | 第五周期、第IVA族 |
颜色、状态 | 银白色固体 | 银白色固体 |
与冷酸作用 | 缓慢反应 | 缓慢反应 |
与强碱溶液 | 不反应 | 反应 |
(1)为了加快步骤①的反应速率,可以采取的措施有______(至少答两点)。
(2)步骤①中铟的氧化物转化成In3+的离子方程式是______。
(3)步骤②中加入过量铟能够除去溶液中的Sn2+,根据所给资料分析其原因是______。
(4)步骤④和⑤中NaOH溶液的作用是______。
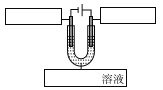
(5)下图是模拟精炼铟的装置图,请在方框中填写相应的物质。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒(①过滤;②蒸发;③溶解;④向容量瓶转移液体),其中玻璃棒的作用及其目的相同的是( )
A.①②
B.①③
C.①④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
A.CO2和SO2 B.CH4和SiO2 C.BF3和NH3 D.HCl和HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
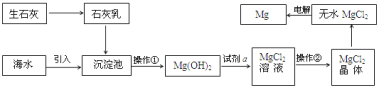
提示: ①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 ________, 操作②的名称___________、冷却结晶、过滤。
(2)试剂a的名称是_____________。
(3)用氯化镁电解生产金属镁的化学方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A,B两容器中气体的体积之比是( )
A.1:2
B.2:1
C.1:1
D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中正确的是( )
A. 化学键存在于原子之间,也存在于分子之间
B. 两个原子之间的相互作用叫做化学键
C. 离子键是阴、阳离子之间的相互吸引力
D. 化学键通常是指相邻的两个或多个原子之间强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______。
a.单质的熔点降低
b.原子半径和简单离子半径均减小
c.元素的金属性减弱,非金属性增强
d.氧化物对应的水化物碱性减弱,酸性增强
(2)氧化性最弱的简单阳离子是_______;热稳定性:H2O____H2S(填>、<、=)。
(3)写出SiCl4的电子式:________。
(4)已知化合物M由第三周期的两种相邻元素按原子个数比1:1组成,不稳定,遇水反应生成谈黄色沉淀A和两种无色有刺意性气味气体B、C,相应物质的转化关系如图:

①已知M的摩尔质量为135g/mol,写出M的化学式_____。
②任选一种合适的氧化剂Y,写出C的浓溶液与Y反应生成D的离子反应方程式_______。
③M中的一种元素可形成化合物KXO3,可用于实验室制O2。若不加催化剂,400℃时KXO3分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com