
【题目】下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
A.CO2和SO2 B.CH4和SiO2 C.BF3和NH3 D.HCl和HI
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
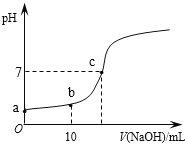
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、渗析、加热分解等.下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒.可用的方法除去Ca(OH)2溶液中悬浮的CaCO3颗粒.
(2)实验室中制取的Fe(OH)3胶体中常常含有杂质Cl﹣ . 可用的方法除去Fe(OH)3胶体中混有的杂质Cl﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度和压强下,a体积的X2气体和3a体积的Y2气体化合生成2a体积的气体化合物,则该化合物的化学式是( )
A.XY3B.XYC.X3YD.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小
C. pH试纸测得新制氯水的pH为4.5
D. FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol氦气所含原子的数目为2NA
B.12 g 12C中所含的碳原子数为NA
C.标况下22.4 L的任何气体所含原子数均为NA
D.相同体积的O2(g)和NO2(g)分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)![]() C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1
②C3H8(g)![]() C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol
③C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
④C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol
(1)计算反应③的反应热△H3=______________。
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
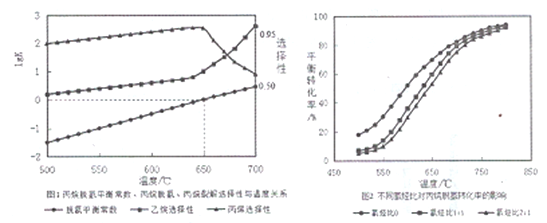
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知: ![]() )
)
(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O和CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A. 通入NH3和CO2的顺序可以互换
B. 操作2为将滤液加热浓缩、冷却结晶、过滤,可得(NH4)2SO4
C. 步骤②中反应的离子方程式为Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+
D. 通入的NH2和CO2均应过量,且工艺流程中CO2可循环利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com