
【题目】工业废水中含+6价的铬会损害环境,必须进行处理。某工厂的处理工艺流程如下:

(1)N2H4的电子式为_____。
(2)下列溶液中,可替代N2H4的是_____。(填选项序号字母)
a.FeSO4溶液 b.浓HNO3溶液 c.酸性KMnO4溶液 d.Na2SO3溶液
(3)已知加入N2H4后,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为_____。
(4)在实际工业生产中,处理含铬废水还可采用直接沉淀的方法,其成本较低。
①已知酸性废水中存在Cr2O72-和CrO42-的转化平衡,请用离子方程式表示它们之间的转化反应_____;
②加入沉淀剂BaCl2溶液之前需加入一定量的NaOH溶液,以利于沉淀的生成,则生成的沉淀为_____(写化学式)。
(5)工业上还可用电解法来处理含Cr2O72-的酸性废水,通过电解制得还原剂。右图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是_____(填“铁”或“石墨”)。
②该处理过程中,Cr2O72-被还原成Cr3+的离子方程式为_____。
【答案】 ![]() ad 2∶3 Cr2O72-+H2O
ad 2∶3 Cr2O72-+H2O![]() 2CrO42-+2H+ BaCrO4 铁 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
2CrO42-+2H+ BaCrO4 铁 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】试题分析:本题以处理含Cr2O72-的工业废水的流程为载体,考查氧化还原反应的基本概念和有关计算,外界条件对化学平衡的影响,电解原理。
(1)N2H4中只存在共价键,电子式为![]() 。
。
(2)根据流程加入N2H4,Cr2O72-被还原成Cr3+,N2H4在反应中作还原剂,能替代N2H4的物质具有还原性,FeSO4溶液、Na2SO3溶液具有还原性,可替代N2H4;浓HNO3溶液、酸性KMnO4溶液具有强氧化性,不能替代N2H4;答案选ad。
(3)N2H4转化为无污染的物质,N2H4被氧化成N2,N2H4作还原剂,N元素的化合价由-2价升至0价;Cr2O72-被还原成Cr3+,Cr2O72-作氧化剂,Cr元素的化合价由+6价降至+3价;根据得失电子守恒,4n(N2H4)=6n(Cr2O72-),n(Cr2O72-):n(N2H4)=2:3,即氧化剂与还原剂物质的量之比为2:3。
(4)①Cr2O72-和CrO42-之间的转化平衡用离子方程式表示为Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
②先加入一定量的NaOH溶液,OH-消耗H+,平衡“Cr2O72-+H2O![]() 2CrO42-+2H+”正向移动,CrO42-浓度增大,则加入沉淀剂BaCl2溶液,生成的沉淀为BaCrO4。
2CrO42-+2H+”正向移动,CrO42-浓度增大,则加入沉淀剂BaCl2溶液,生成的沉淀为BaCrO4。
(5)①根据题意通过电解制得还原剂,铁为活性电极,石墨为惰性电极,则Fe作阳极,Fe失电子生成还原剂Fe2+,装置中b电极为阳极,则b电极的材料是铁。
②电解时阳极电极反应式为Fe-2e-=Fe2+,Cr2O72-被还原成Cr3+,则Fe2+被氧化成Fe3+,反应可写成Fe2++Cr2O72-→Fe3++Cr3+,根据得失电子守恒配平为6Fe2++Cr2O72-→6Fe3++2Cr3+,结合废水呈酸性和原子守恒,写出离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:
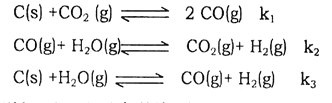
则K1、K2、K3之间的关系是K3=__________________
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2O和Na2O2的叙述正确的是( )
A.Na2O与Na2O2均可与水反应生成氢氧化钠,所以都是碱性氧化物
B.Na2O与Na2O2分别与CO2反应的产物完全相同
C.常温下,钠在空气中反应生成过氧化钠
D.在呼吸面具中,Na2O2常作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你回答下列问题:
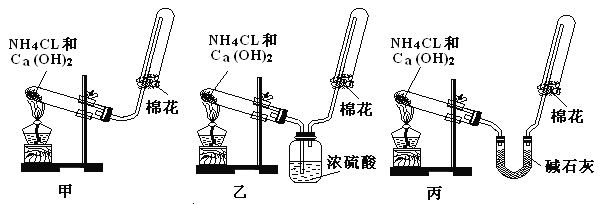
(1)三位同学制取氨气的化学方程式为:___________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是_______ 填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)__________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_______ (填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?_______ (填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
观点一是:“理论派”认为电解氯化铜溶液后溶液的pH 升高。
观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如下图曲线的关系。
pH与时间关系图
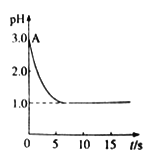
请回答下列问题:
(1)电解前氯化铜溶液的pH处在A 点位置的原因是______________________(用离子方程式说明)。
(2)“理论派”所持观点的理论依据是________________________。
(3) “实验派”实验结论是_________________。他们所述“精确实验”是通过______________确定的。
(4)若“实验派”的观点正确,那么你认为他们所持观点的理由是______________________(用化学方程式和必要的文字加以简述)。
【答案】 Cu2++2H2O![]() Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2
Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2![]() Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
【解析】本题主要考查平衡状态的移动。
(1)电解前氯化铜溶液的pH处在A点位置的原因是Cu2++2H2O![]() Cu(OH)2+2H+。
Cu(OH)2+2H+。
(2)“理论派”所持观点的理论依据是因为Cu2++2e-=Cu,c(Cu2+)减小,使Cu2+水解平衡向左移动,c(H+)减小,pH上升。
(3)“实验派”实验结论是pH降低。他们所述“精确实验”是通过测定溶液pH确定的。
(4)若“实验派”的观点正确,那么他们所持观点的理由是CuCl2![]() Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
【题型】填空题
【结束】
22
【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com