
【题目】(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:
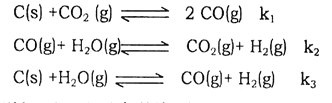
则K1、K2、K3之间的关系是K3=__________________
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)________________
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
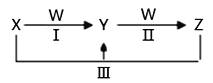
(1)若X是烧碱,Z是小苏打。
① W的分子式是____________________。
② 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
(2)若X是氯气、Z是氯化亚铁。
① 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
② Y可作净水剂,其原理是_________________________(用离子方程式表示)。在使用时发现Y不能使酸性废水中的悬浮物沉降除去,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
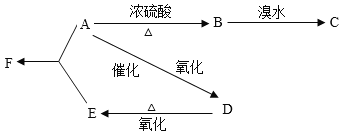
【题目】某有机物A由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、D。已知B的产量通常用来衡量一个国家的石油化工水平,转变关系如下:
(已知: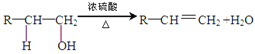 、
、![]() )
)
(1)写出A、B、C、D、E、F的结构简式:A:_______,B:________,C:__________,D:____________,E:____________,F:____________。
(2)写出实现下列转化的化学方程式,并注明反应类型:
A→B___________________________________________________________________;
B→C___________________________________________________________________;
A→D___________________________________________________________________;
A+E→F_________________________________________________________________;
(3)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为____________,该溶液的主要作用是____________;该装置图中有一个明显的错误是_______________________________。
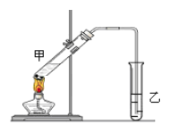
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 新发现的核素![]() 中,电子数比中子数多179
中,电子数比中子数多179
B. 白磷和红磷互为同分异构体
C. 氕、氘、氚互为同素异形体
D. CH3CH2CH2CH3 和C(CH3)4互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含+6价的铬会损害环境,必须进行处理。某工厂的处理工艺流程如下:

(1)N2H4的电子式为_____。
(2)下列溶液中,可替代N2H4的是_____。(填选项序号字母)
a.FeSO4溶液 b.浓HNO3溶液 c.酸性KMnO4溶液 d.Na2SO3溶液
(3)已知加入N2H4后,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为_____。
(4)在实际工业生产中,处理含铬废水还可采用直接沉淀的方法,其成本较低。
①已知酸性废水中存在Cr2O72-和CrO42-的转化平衡,请用离子方程式表示它们之间的转化反应_____;
②加入沉淀剂BaCl2溶液之前需加入一定量的NaOH溶液,以利于沉淀的生成,则生成的沉淀为_____(写化学式)。
(5)工业上还可用电解法来处理含Cr2O72-的酸性废水,通过电解制得还原剂。右图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是_____(填“铁”或“石墨”)。
②该处理过程中,Cr2O72-被还原成Cr3+的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com