
【题目】贮存 Cl2 的钢瓶上应贴的标签为( )
A.有毒品B.爆炸品C.易燃品D.腐蚀品
科目:高中化学 来源: 题型:
【题目】(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:
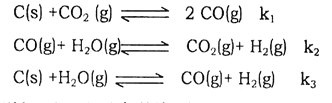
则K1、K2、K3之间的关系是K3=__________________
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列古诗词的描述中发生的是化学变化的是( )
A.千淘万漉虽辛苦,吹尽狂沙始到金
B.忽如一夜春风来,千树万树梨花开
C.春蚕到死丝方尽,蜡炬成灰泪始干
D.日照香炉生紫烟,遥看瀑布挂前川
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中导电粒子的数目减少
B. 溶液中![]() 不变
不变
C. 醋酸的电离程度增大,c(H+)亦增大
D. 再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
观点一是:“理论派”认为电解氯化铜溶液后溶液的pH 升高。
观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如下图曲线的关系。
pH与时间关系图
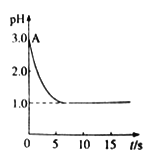
请回答下列问题:
(1)电解前氯化铜溶液的pH处在A 点位置的原因是______________________(用离子方程式说明)。
(2)“理论派”所持观点的理论依据是________________________。
(3) “实验派”实验结论是_________________。他们所述“精确实验”是通过______________确定的。
(4)若“实验派”的观点正确,那么你认为他们所持观点的理由是______________________(用化学方程式和必要的文字加以简述)。
【答案】 Cu2++2H2O![]() Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2
Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2![]() Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
【解析】本题主要考查平衡状态的移动。
(1)电解前氯化铜溶液的pH处在A点位置的原因是Cu2++2H2O![]() Cu(OH)2+2H+。
Cu(OH)2+2H+。
(2)“理论派”所持观点的理论依据是因为Cu2++2e-=Cu,c(Cu2+)减小,使Cu2+水解平衡向左移动,c(H+)减小,pH上升。
(3)“实验派”实验结论是pH降低。他们所述“精确实验”是通过测定溶液pH确定的。
(4)若“实验派”的观点正确,那么他们所持观点的理由是CuCl2![]() Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
【题型】填空题
【结束】
22
【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快) 4VO2+O2
2VO2+SO3(快) 4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com