
【题目】工业上使用Au 基体催化CO2 合成甲酸的反应过程如图所示。下列说法不正确的是
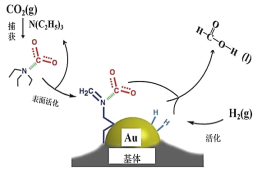
A.二氧化碳的电子式为![]()
B.在捕获过程,二氧化碳分子中的共价键完全断裂
C.N(C2H5)3 能够协助二氧化碳到达催化剂表面
D.CO2 催化加氢合成甲酸的总反应式为H2(g)+CO2(g)=HCOOH(l)
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )

A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
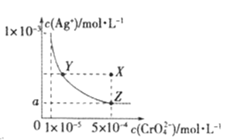
A.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
B.T℃时,在Y点和X点,水的离子积Kw相等
C.图中a=![]() ×10-4
×10-4
D.向饱和Ag2CrO4溶液中加入固体AgNO3能使溶液由Z点变为X点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容下,某容器中进行如下反应:H2![]() 2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
A.等于18sB.等于12sC.大于18sD.小于18s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
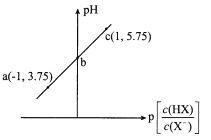
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系不正确的是( )
A.物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
B.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③
D.等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了以下实验测定Cu—Ag合金与浓硝酸的反应。其实验装置如图:

请回答下列问题:
(1)F仪器的名称是_______________,作用是____________________________。
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为____________________________;装置A中盛放的是酸性高锰酸钾溶液,作用是___________________________________________。
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后__________(填操作步骤),再将B装置分液漏斗中的浓硝酸缓慢滴加到三颈烧瓶中。
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
滴定前体积/mL | 滴定后体积/mL | |
笫一次 | 0.33 | 20.32 |
笫二次 | 1.25 | 23.26 |
笫=.次 | 1.47 | 21.48 |
装置D中生成的硝酸为________mol,则Cu-Ag合金与浓硝酸反应过程中生成的NO2在标准状况下的体积为__________mL。
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积_________(填“偏大”或“偏小”),此时应将量气筒的位置_______(填“下移”或“上移”),以保证量气筒中的液面与干燥管中的液面持平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:
准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
(1)高锰酸钾溶液应装在______________________________滴定管中。(填“酸式”或“碱式”)
(2)滴定至终点时的实验现象是:___________________________________
(3)下列操作可能使测量结果偏高的是__________________________________;
A、盛装的Na2C2O4的滴定管没润洗
B、盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C、读数时滴定前仰视,滴定后俯视
D、锥形瓶中残留少量水
(4)计算样品中Na2C2O4的纯度___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com