
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。
【答案】K1×K2 < < 0.10mol/(Lmin) 625
【解析】
(1)根据反应①与②的平衡常数表达式推导出反应③的平衡常数表达式,导出K1、K2与K3之间的关系;
(2)计算出不同温度下的K3,找到变化规律进行判断;
(3)通过Qc与K3之间的大小关系进行判断;
(4)①根据υ=![]() 计算反应速率;
计算反应速率;
②利用三段法进行计算。
(1)K1=![]() ,K2=
,K2=![]() ,K3=
,K3=![]() ,则有K3=K1×K2
,则有K3=K1×K2
(2)500℃时,K3=2.5,800℃时,K3=0.375,温度升高,平衡常数减小,可知正反应为放热反应,ΔH<0;
(3)500℃时,Qc=![]() =100>K3,反应逆向进行,即υ正<υ逆;
=100>K3,反应逆向进行,即υ正<υ逆;
(4)①υ(CH3OH)=![]() =
=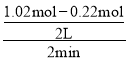 =0.2 mol/(Lmin),υ(CH3OCH3)=
=0.2 mol/(Lmin),υ(CH3OCH3)=![]() υ(CH3OH)= 0.1 mol/(Lmin);
υ(CH3OH)= 0.1 mol/(Lmin);
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
始(mol/L) 0.51 0 0
转(mol/L) 0.5 0.25 0.25
平(mol/L) 0.01 0.25 0.25
平衡常数K=![]() =
=![]() =625。
=625。


科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200 ℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+![]() O2(g)= SO2(g)+H2O(g) ΔH1,H2S(g)+
O2(g)= SO2(g)+H2O(g) ΔH1,H2S(g)+![]() O2(g)= S(g)+H2O(g) ΔH2,2H2S(g)+SO2(g)=
O2(g)= S(g)+H2O(g) ΔH2,2H2S(g)+SO2(g)= ![]() S2(g)+2H2O(g) ΔH3,2S(g)= S2(g) ΔH4 ,则ΔH4的正确表达式为( )
S2(g)+2H2O(g) ΔH3,2S(g)= S2(g) ΔH4 ,则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1+ΔH3-3ΔH2)B.ΔH4=
(ΔH1+ΔH3-3ΔH2)B.ΔH4=![]() (3ΔH2-ΔH1-ΔH3)
(3ΔH2-ΔH1-ΔH3)
C.ΔH4=![]() (ΔH1+ΔH3-3ΔH2)D.ΔH4=
(ΔH1+ΔH3-3ΔH2)D.ΔH4=![]() (ΔH1-ΔH3-3ΔH2)
(ΔH1-ΔH3-3ΔH2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
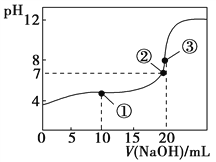
A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1molL-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1molL-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法不正确的是( )

A.NaX溶液呈碱性B.P点:c(Na+)>c(H+)
C.M点:c(HX)+c(X-)=2c(Na+)D.M点水电离程度小于N点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测溶液pH可研究反应过程。用盐酸分别滴定Na2CO3、 NaHCO3溶液,测得pH随加入盐酸体积的变化如下图所示(曲线②从B1点开始滴定)。下列判断不正确的是

A. 曲线①表示用盐酸滴定Na2CO3的过程
B. B、C1点均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 曲线①、②说明Na2CO3与盐酸的反应分步进行
D. BC段和B1C1段发生的主要反应均是HCO3ˉ+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是
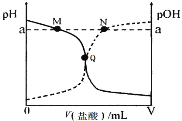
A.M点所示溶液c(![]() )+c(NH3·H2O)= c(Cl-)
)+c(NH3·H2O)= c(Cl-)
B.N点所示溶液中:c(![]() )>c(Cl-)
)>c(Cl-)
C.Q点所示消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的离子积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com