
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
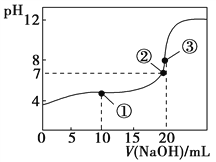
A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
【答案】D
【解析】A、在曲线上任一点均存在电荷守恒:c(Na+)-c(OH-)=c(CH3COO-)-c(H+),选项A正确;B、点①所示溶液是醋酸和醋酸钠按1:1形成的溶液,电荷守恒有c(Na+) +c(H+)=c(CH3COO-)+c(OH-),物料守恒有2c(Na+)= c(CH3COO-)+ c(CH3COOH),前式代入后式得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项B正确;C、点②所示溶液呈中性,c(OH-)= c(H+),根据电荷守恒得c(Na+)=c(CH3COO-),选项C正确;D、点③所示氢氧化钠与醋酸完全中和,为醋酸钠溶液,呈碱性:c(Na+)> c(CH3COO-)> c(OH-)>c (H+),选项D不正确。答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列分子或离子中都存在着配位键的是( )
A.NH3、H2O B.NH4+、H3O+ C.N2、HClO D.[Cu(NH3)4]2+、PCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

⑴氯化水解法生产三氯氧磷的化学方程式为______。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是______(选填字母),滴定终点的现象为______。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉
②实验过程中加入硝基苯的目的是_____________________,如无此操作所测Cl元素含量将会______(填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是_________________。
②下图是不同条件对磷的沉淀回收率的影响图像。
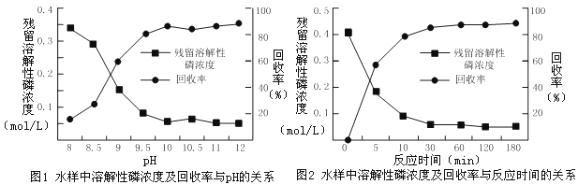
处理该厂废水最合适的工艺条件为______(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)=__________mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g) + I2(g) ![]() 2HI(g)达到平衡的标志是 ( )
2HI(g)达到平衡的标志是 ( )
A. H2、I2、HI的浓度相等 B. H2、I2、HI的浓度保持不变
C. 混合气体的密度保持不变 D. 混合气体的体积保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对盐类物质可有下列分类:如氯化硝酸钙[Ca(NO3)Cl]是一种混盐,硫酸铝钾KAl(SO4)2是一种复盐,冰晶石(六氟合铝酸钠)Na3AlF6是一种络盐。对于组成为CaOCl2的盐可归类于( )
A. 混盐 B. 复盐 C. 络盐 D. 无法归属于上述类别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:

①写出表示丙烷燃烧热的热化学方程式:_________________________。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g)C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) ![]() 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融) ![]() Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是

A. 电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com