
【题目】(1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:

①写出表示丙烷燃烧热的热化学方程式:_________________________。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g)C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
【答案】 C3H8(g)+5O2(g)3CO2(g)+4H2O(l)ΔH=-2 215 kJ·mol-1 1∶3 0.5(Q3-Q2+3Q1)
【解析】本题主要考查有关反应热的计算。
(1)①丙烷完全燃烧生成CO2和1molH2O(l)放热553.75kJ,表示丙烷燃烧热的热化学方程式: C3H8(g)+5O2(g)3CO2(g)+4H2O(l)ΔH=-2215kJ·mol-1。
②根据题意可得n(二甲醚)+n(丙烷)=1mol和n(二甲醚)×1455kJ+n(丙烷)×2215kJ=1645kJ,解得n(二甲醚)=0.75mol,n(丙烷)=0.25mol,则混合气体中,丙烷和二甲醚的物质的量之比为1:3。
(2)将已知3个热化学方程式依次表示为a、b、c,3a-b+c得C2H5OH(l)+3O2(g)2CO2(g)+3H2O(l) ΔH=3ΔH1-ΔH2+ΔH3=-((Q3-Q2+3Q1))kJ·mol-1
若使23g即0.5mol液态无水酒精完全燃烧并恢复到室温,则整个过程中放出的热量为0.5(Q3-Q2+3Q1)kJ。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(?)![]() xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
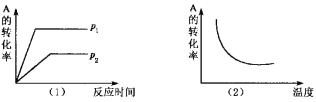
A. △H >0,m+n>x,同时B为非气态
B. △H >0,m+n<x,同时B为气态
C. △H <0,m+n>x,同时B为气态
D. △H <0,m<x,同时B为非气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
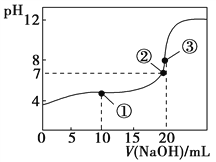
A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是
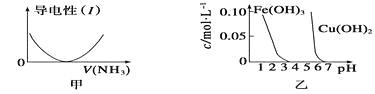

A. 图甲表示向盐酸溶液中通入NH3过程中溶液导电性的变化
B. 由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
C. 图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D. 图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是________。
2NH3(g) △H<0。右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是________。
a. t0→t1 b.t2→t3 c.t3→t4 d.t5→t6
t4时改变的条件是_______________。

Ⅱ、已知反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) H=akJ·mol-1测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
FeO(s)+CO(g) H=akJ·mol-1测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则这段时间内,用CO表达的反应速率为__________.(填写计算所得数值及单位)
(2)下列图像符合该反应的是_____________(填序号)(图中v代表速率、ω代表混合物中CO的含量,T代表温度)。


(3)下列能说明此反应在500℃达到平衡状态的是___________
①CO的体积分数不变
②固体质量不变
③恒压条件下,气体的体积不变
④恒容条件下,容器内压强不再改变
⑤c(CO)=c(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1几种弱酸的电离常数(25℃)
酸 | 电离常数(K) |
CH3COOH | 1.8×10-5 |
HNO2 | 5.1×10-4 |
HCN | 6.2×10-10 |
HClO | 3×10-8 |
表2几种难溶电解质的溶度积(25℃)
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1.1×10-10 |
MgCO3 | 6.8×10-6 |
CaSO4 | 9.1×10-6 |
CaCO3 | 2.8×10-9 |
请回答下列问题:
(1)表1四种酸中,酸性最强的是____________(用化学式表示)。会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是__________。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)常温下,相同物质的量浓度的表1中4种酸的钠盐pH由大到小的顺序是______________________________ (填钠盐的化学式)。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)①根据表2四种难(微)溶物的溶度积常数计算BaSO4的溶解度_______________(单位用g/L)表示,(已知![]() )。
)。
②在含有100mL0.2mol/L Ba2+、Ca2+、Mg2+的混合溶液中加入100mL0.1mol/LNa2SO/span>4溶液,反应后溶液中生成的沉淀是_________,此时SO42-的浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com