
����Ŀ������1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH�������� ![]() 4Na��O2����2H2O��������������������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ3Fe��4NaOH��������
4Na��O2����2H2O��������������������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ3Fe��4NaOH�������� ![]() Fe3O4��2H2����4Na���������й�˵����ȷ����
Fe3O4��2H2����4Na���������й�˵����ȷ����

A. ������������������ƣ����������ĵ缫��ӦΪ2OH����2e��===H2����O2��
B. ���������˷�����ԭ�����������Ļ�ԭ�Ա���ǿ
C. ����ά������������˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ�������Ҳ��ͬ
D. Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ�����������ͼ����������ʯīΪ��������Ϊ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000 mol��L��1 NaOH��Һ�ζ�20.00 mL 0.1000 mol��L��1 CH3COOH��Һ���õζ�������ͼ������˵������ȷ���ǣ� ��
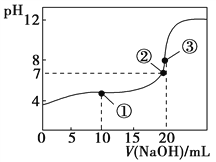
A. ����������һ������ڣ�c(Na��)c(OH��) = c(CH3COO��)c(H��)
B. �����ʾ��Һ�У�c(CH3COO��)��2c(OH��) = c(CH3COOH)��2c(H��)
C. �����ʾ��Һ�У�c(Na��) = c(CH3COO��)
D. �����ʾ��Һ�У�c(Na��) > c(OH��) > c(CH3COO��) > c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ҫ�����ǣ����������ֱ�� ���������� ��������Է������� ������ľ���
A.�ڢۢ�B.�ڢ�C.�٢ۢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������в���ȷ����
A.����һ�����ʵ���Ũ�ȵ���Һʱ����ƿ�����Ƿ�©ˮ
B.��������ʱ����������������Һ�壬ֹͣ���ȣ�����������ʹˮ����ȫ����
C.�������ʱ���¶ȼ�ˮ��������������ƿ��֧�ܿڸ���
D.��Һ����ʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ��Ҳ���¿ڷų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�о�����ȷ˵���ǣ� ��
A. ͬʱ�ı������������о���Ӧ���ʵı仯���ܸ���ó��йع���
B. ��HF��HCl��HBr��HI���Ե�������ʵ���Ƴ�F����Cl��Br��I�ķǽ��������Ĺ���
C. ���á���ˮ��������þ���Ȼ�þ������þ���Ĺ���������������þ
D. ���ݶ��������ɽ���ɢϵ��Ϊ��Һ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����( )
ѡ�� | ʵ����� | ���ӷ���ʽ |
A | FeCl3��Һ��KI��Һ��Ӧ | 2Fe3++2I-=2Fe2+ +I2 |
B | A1C13��Һ�м��������İ�ˮ | A13++30H- = Al(OH)3 |
C | ��������ˮ | Cl2 + H20=2H+ +CI-+CIO- |
D | ��ϡHN03�еμ�Na2S03��Һ | SO2- + 2H+=SO2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�������ֺ������壬25 ��ʱ�����ǵ����ʵ���������pH �ı仯��ͼ��ʾ�����������������

A. ��pH=5 �ĸ���������Һ�м���KOH��Һ�����ӷ���ʽΪHFeO4��+OH����FeO42��+H2O
B. Ϊ��þ����ܴ����ĸ������Σ�Ӧ����pH��9
C. ��֪H3FeO4+�ĵ���ƽ�ⳣ���ֱ�Ϊ��K1=2.5��10-2��K2=4.8��10-4��K3=5.0��10-8����pH= 4ʱ����Һ��c(HFeO4��)/ c(H2FeO4)= 1.2
D. pH=2 ʱ����Һ����Ҫ��������Ũ�ȵĴ�С��ϵΪ c(H2FeO4)> c(H3FeO4+)> c(HFeO4��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��D2O������Ҫ�Ĺ�ҵԭ�ϣ�����˵��������ǣ� ��
A. H2O��D2O����ͬ��������
B. 4gD2��20g18O2�ĵ��ʻ���ʱ������������22gD218O
C. ��״���£�뭣�H����뮣�D���(T)��Ӧ�ĵ��ʵ��ܶ�֮��Ϊ1:2:3
D. 1H��D����ͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20mL 1molL��1��Al2��SO4��3��Һ�м���20mLNaOH��Һ����ַ�Ӧ�ɵ�1.56g������������NaOH��Һ�����ʵ���Ũ�ȿ�����____��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com