
【题目】铁氰化钾(化学式为K3[Fe(CN)6])在工业上主要应用于制药、电镀、造纸、钢铁生产,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。回答下列问题:
(1)Fe3+比Fe2+稳定的原因______。
(2)在[Fe(CN)6]3-中不存在的化学键为______。
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为______。
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是______,分子中σ键和π键数目之比为______。
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______。
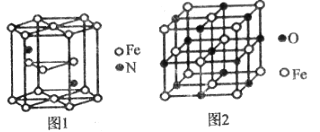
(5)已知:氧化亚铁晶体的密度为pgcm-3,NA表示阿伏加德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______;Fe2+与O2-的最短核间距为______pm。
【答案】Fe3+的价电子排布式为3d5,半充满状态,能量低 A N>O>C>K sp、sp2 2:1 3:1 12 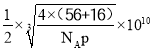 pm或
pm或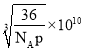 pm
pm
【解析】
(1)Fe3+的价电子排布式为3d5,Fe2+的价电子排布式为3d6,根据洪特规则进行分析;
(2)根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①K为金属元素,容易失去电子,第一电离能最小,C、N、O中N的2p能级上有3个电子,处于半满状态,能量最低;
②利用价层电子对数等于杂化轨道数进行分析;成键原子间只能形成一个σ键,剩余为π键;(4)按照均摊法进行分析;
(5)根据晶胞结构,与O2-紧邻且等距的O2-同层4个,上层4个,下层4个;利用均摊法计算出微粒个数,从而计算出晶胞的质量,Fe2+和O2-最短的核间距是边长的一半,因此根据密度求出晶胞的体积,从而计算出边长;
(1) Fe3+的价电子排布式为3d5,处于半满,能量低,Fe2+的价电子排布式为3d6,因此Fe3+比Fe2+稳定;
(2)[Fe(CN)6]3-是阴离子,是配合物的内界,含有共价键和配位键,不含有离子键和氢键,但氢键属于分子间作用力,不属于化学键,故A符合题意;
(3)①K是活泼金属,容易失去电子,第一电离能最小,同周期从左向右第一电离能逐渐增大,但ⅡA>ⅢA,ⅤA>ⅥA,因此第一电离能大小顺序是N>O>C>K;
②“CH2=CH”中C有3个σ键,无孤电子对,因此C的杂化方式为sp2,叁键中C的杂化类型sp;单键为σ键,双键中有1个σ键和1个π键,叁键中有1个σ键和2个π键,分子中σ键和π键数目之比为6:3=2:1;
(4)Fe位于顶点、面心、内部,顶点被六个这样的晶胞共用,面心被2个晶胞共用,个数为![]() =6,N位于内部,个数为2,因此铁、氮的微粒个数之比为6:2=3:1;
=6,N位于内部,个数为2,因此铁、氮的微粒个数之比为6:2=3:1;
(5) 根据晶胞结构,与O2-紧邻且等距的O2-同层4个,上层4个,下层4个,共有12个;晶胞的质量为![]() g,根据密度的定义,该晶胞的边长为
g,根据密度的定义,该晶胞的边长为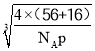 cm,Fe2+和O2-的最短核间距为边长的一半,因此最短距离是
cm,Fe2+和O2-的最短核间距为边长的一半,因此最短距离是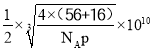 pm或
pm或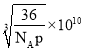 pm。
pm。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、![]()
B.使紫色石蕊溶液变红的溶液中:![]() 、Ba2+、
、Ba2+、![]() 、Cl-
、Cl-
C.pH=12的溶液中:K+、Na+、CH3COO-、Br-
D.滴加几滴KSCN溶液显血红色的溶液中:![]() 、Mg2+、I-、Cl-
、Mg2+、I-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__。
(2)丙溶液中存在的电离平衡为__(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是__(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应 B. 与NaOH水溶液共热
C. 在催化剂存在下与氢气作用 D. 与银氨溶液作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
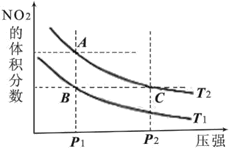
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
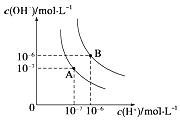
【题目】水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度。则表示25℃的是________(填“A”或“B”)。100℃时,在1molL﹣1的NaOH溶液中,由水电离出的c(H+)=________molL﹣1 。 100℃时,5×10﹣5 molL﹣1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com