
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
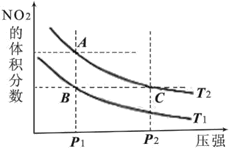
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
【答案】D
【解析】
升高温度,平衡正向移动,二氧化氮的体积分数增大,因此T1<T2。
A、相同温度下压强越大,反应速率越快,A、C两点的反应速率:C>A,选项A错误;
B、相同温度下增大压强(即缩小体积)最终达到新的平衡,平衡体系中各种气体的浓度均增大,因此A、C两点气体的颜色:A浅、C深,选项B错误;
C、平衡体系中气体的总质量不变,气体的总物质的量越小,平均相对分子质量越大,A点对应气体的总物质的量大于B点,因此A、B两点气体的平均相对分子质量:A<B,选项C错误;
D、平衡常数仅是温度的函数,正向进行的程度越大,平衡常数越大,因此b、c两点化学平衡常数:B<C,选项D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在产生了AgCl沉淀的试管中,加入KI溶液,白色沉淀变为黄色。下列说法正确的是( )
A.该实验说明I-还原性比Cl-强B.该实验说明Ksp(AgCl)<Ksp(AgI)
C.该实验说明AgI溶解度比AgCl小D.KI的加入对AgCl的溶解平衡没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])在工业上主要应用于制药、电镀、造纸、钢铁生产,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。回答下列问题:
(1)Fe3+比Fe2+稳定的原因______。
(2)在[Fe(CN)6]3-中不存在的化学键为______。
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为______。
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是______,分子中σ键和π键数目之比为______。
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______。
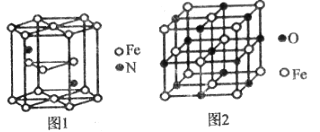
(5)已知:氧化亚铁晶体的密度为pgcm-3,NA表示阿伏加德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______;Fe2+与O2-的最短核间距为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示。
已知:室温下,①2NO+Na2O2=2NaNO2
②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5 NO2— + 2MnO4—+ 6H+= 5NO3—+ 2Mn2++ 3H2O
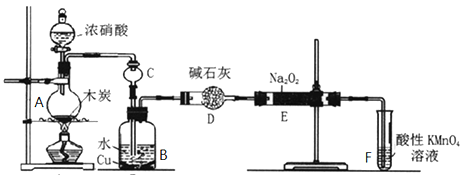
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物__________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 mL,取出25 mL溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
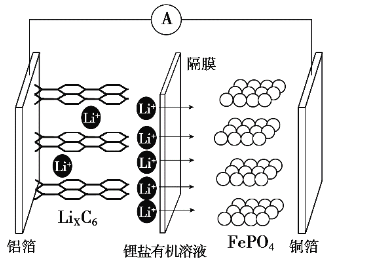
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式书写正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
B.HS-的水解方程式:HS-+H2O![]() H3O++S2-
H3O++S2-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.BaSO4的沉淀溶解平衡表达式:BaSO4(s) ![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器甲乙丙中,分别依次加入下列各选项中所对应的试剂进行实验。能达到实验目的的是( )
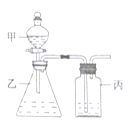
A.浓盐酸、高锰酸钾、浓硫酸,制取纯净的氯气
B.浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
C.稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有碳酸根离子
D.稀硫酸、碳酸钠、次氯酸钠,验证硫酸、碳酸、次氯酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
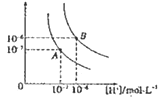
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
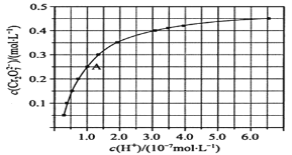
(1)CrO42-和Cr2O72-在溶液中相互转化的离子方程式___。
(2)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com