
【题目】下列表达式书写正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
B.HS-的水解方程式:HS-+H2O![]() H3O++S2-
H3O++S2-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.BaSO4的沉淀溶解平衡表达式:BaSO4(s) ![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__。
(2)丙溶液中存在的电离平衡为__(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是__(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
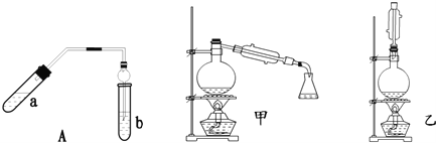
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
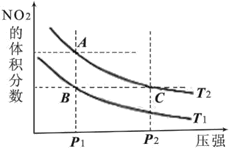
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
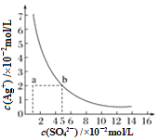
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能固氮反应条件苛刻,计算机模拟该历程如图所示,在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的( )
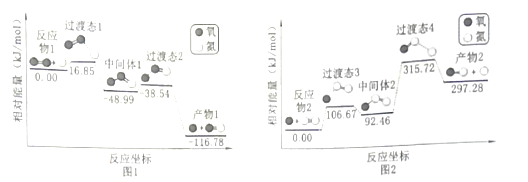
A.图1中,中间体1到产物1的方程式为O-O═N→O+N═O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72kJmol-1
D.由N和O2制NO的过程比由O原子和N2制NO的过程速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。
①ΔH=__kJ/mol。
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有___(填字母)。
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。
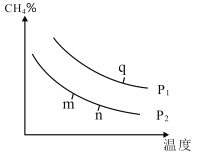
①p1___p2(填“<”、“>”或“=”),该反应为___(填吸或放)热反应。
②m、n、q三点的化学平衡常数大小关系为__。
③若q点对应的纵坐标为30,此时甲烷的转化率为___,该条件下的化学平衡常数Kp=___(用含有P1的表达式表示,Kp为以分压表示的平衡常数)。
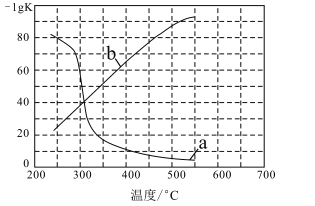
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的___(填a、b),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L带气压计的恒容密闭容器中通入2 molX(g)和1molY(g),发生反应:2X(g)+Y(g)![]() 2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为__。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲。
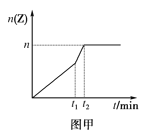
若n=0.9mol,t1时刻改变的条件是__(填选项编号,A.升温 B.降温 C.加压 D.减压 E.加催化剂),t2__5min(填“>”“<”或“=”,下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量__0.9mol。
(4)若将物质的量均为3mol的物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
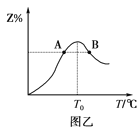
①A、B两点Z物质正反应速率的大小关系是__;(速率用A、B表示)
②温度T<T0时,Z%逐渐增大的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com