
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。
①ΔH=__kJ/mol。
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有___(填字母)。
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。
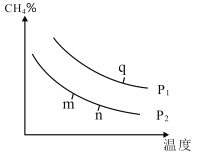
①p1___p2(填“<”、“>”或“=”),该反应为___(填吸或放)热反应。
②m、n、q三点的化学平衡常数大小关系为__。
③若q点对应的纵坐标为30,此时甲烷的转化率为___,该条件下的化学平衡常数Kp=___(用含有P1的表达式表示,Kp为以分压表示的平衡常数)。
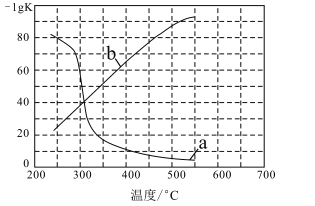
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的___(填a、b),理由是___。
【答案】(b+3c-a-d) AB > 吸 Km<Kn<Kq 25% 0.03P12 a 正反应为吸热反应,升高温度,平衡常数增大,负对数减小,曲线a满足
【解析】
(1)①依题意分别写出燃烧热化学反应方程式,利用盖斯定律解答;
②依据可逆反应处于平衡状态的判断方法分析;
(2)①CH4(g)+H2O(g)CO(g)+3H2(g),正反应是体积增大的反应,结合图像分析在压强不变的情况下升高温度,CH4体积分数减小,根据勒夏特列原理分析;
②化学平衡常数只受温度影响,结合图示各点的温度大小和反应的移动方向判断平衡常数大小关系;
③根据题意和图像结合三段式解答计算;
(3)正反应为吸热反应,分析温度对平衡移动的影响。
(1)①CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。
可得:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-akJ/mol;
②CO(g)+![]() O2(g)=CO2(g) △H2=- bkJ/mol;
O2(g)=CO2(g) △H2=- bkJ/mol;
③H2(g)+![]() O2(g)=H2O(l) △H3=-ckJ/mol;
O2(g)=H2O(l) △H3=-ckJ/mol;
④H2O(l)=H2O(g) △H4=+dkJ/mol;
根据盖斯定律:①-②-③×3-④可得CH4(g)+H2O(g)CO(g)+3H2(g) △H=(b+3c-a-d) kJ/mol;
②A.v正(CH4)=v逆(H2O),等式中有正反应速率,逆反应速率,且成系数比,可说明正逆反应速率相等,反应达到平衡状态,故A正确;
B.气体压强不再变化,即气体分子数不变,可以判断平衡状态,故B正确;
C.单位时间每消耗1molCH4,同时产生3molH2是相同的反应方向,不能判断平衡状态,故C错误;
D.CH4与H2的物质的量之比为1∶3不能说明物质的量及物质的量浓度不变,无法判断平衡状态,故D错误;
答案选AB;
(2)①CH4(g)+H2O(g)CO(g)+3H2(g),正反应是气体体积增大的反应,增大压强平衡逆向移动,甲烷的体积分数增多,故p1>p2;结合图像分析可知,在压强不变的情况下升高温度,CH4体积分数减小,说明平衡正向移动,故该反应为吸热反应;
②化学平衡常数只受温度影响,正反应吸热,升高温度,K增大,故Km<Kn<Kq;
③若q点对应的纵坐标为30,说明甲烷的体积分数为30%,根据“三段式”:

则![]() =30%,可得x=0.5,故甲烷的转化率=
=30%,可得x=0.5,故甲烷的转化率=![]() ×100%=25%,相同条件下,物质的量之比等于压强之比,该条件下的化学平衡常数Kp=
×100%=25%,相同条件下,物质的量之比等于压强之比,该条件下的化学平衡常数Kp=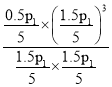 =0.03
=0.03![]() 2;
2;
(3)正反应为吸热反应,升高温度,平衡常数增大,负对数减小,曲线a满足。


科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量Na2CO3固体,c(OH-)增大,Kw不变,影响水的电离平衡
D.向纯水中加入盐酸,可抑制水的电离;加入醋酸,可促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式书写正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
B.HS-的水解方程式:HS-+H2O![]() H3O++S2-
H3O++S2-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.BaSO4的沉淀溶解平衡表达式:BaSO4(s) ![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生活和生产中有着重要应用,科学使用含硫化合物对人体健康及环境保护意义重大。
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被__(填“氧化”、“还原”)。
(2)氢的硫化物有多种:H2Sx(x=1,2,3,…),如H2S2,其结构与H2O2相似。请写出H2S3的结构式__。
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),反应中断裂的化学键类型为__。
(4)淮北某课题小组对连二亚硫酸钠(Na2S2O4)进行了如下探究。将0.050ml·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示(忽略溶液体积的变化)。
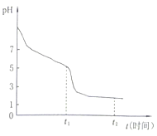
①Na2S2O4溶液显__性,原因是__(用离子方程式表示)。
②t1时溶液中只有一种溶质,此时含硫元素的粒子浓度由大到小的顺序为___。
0-t1段发生反应的离子方程式为__,t1-t2段溶液的pH变小的原因是__(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
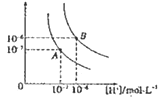
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
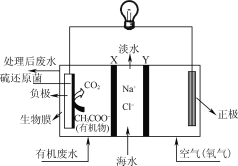
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 增大压强
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com