
【题目】含硫化合物在生活和生产中有着重要应用,科学使用含硫化合物对人体健康及环境保护意义重大。
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被__(填“氧化”、“还原”)。
(2)氢的硫化物有多种:H2Sx(x=1,2,3,…),如H2S2,其结构与H2O2相似。请写出H2S3的结构式__。
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),反应中断裂的化学键类型为__。
(4)淮北某课题小组对连二亚硫酸钠(Na2S2O4)进行了如下探究。将0.050ml·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示(忽略溶液体积的变化)。
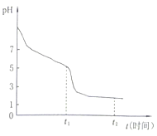
①Na2S2O4溶液显__性,原因是__(用离子方程式表示)。
②t1时溶液中只有一种溶质,此时含硫元素的粒子浓度由大到小的顺序为___。
0-t1段发生反应的离子方程式为__,t1-t2段溶液的pH变小的原因是__(用离子方程式表示)。
【答案】氧化 ![]() 离子键、共价键 碱 S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH- c(HSO3-)>c(SO32-)>c(H2SO3) 2S2O42-+O2+2H2O=4HSO3- 2HSO3-+O2=2H++2SO42-
离子键、共价键 碱 S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH- c(HSO3-)>c(SO32-)>c(H2SO3) 2S2O42-+O2+2H2O=4HSO3- 2HSO3-+O2=2H++2SO42-
【解析】
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被氧化,故答案为:氧化;
(2)氢的硫化物有多种,其结构与H2O2相似,说明硫原子间形成一个单键两端和氢原子形成共价键,H2S3的结构式![]() ,故答案为:
,故答案为:![]() ;
;
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),一定破坏了离子键,酸根离子变化,证明生成了新的共价键,反应中断裂的化学键类型为:离子键、共价键,故答案为:离子键、共价键;
(4)①Na2S2O4溶液中溶质为强碱弱酸盐,溶液中S2O42-离子分步水解,溶液显碱性,水解离子方程式:S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH-,故答案为:碱;S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH-;
②t1时溶液中只有一种溶质,Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,溶液显酸性,说明亚硫酸氢根离子电离程度大于其水解程度,溶液中含硫元素的粒子浓度由大到小的顺序为:c(HSO3-)>c(SO32-)>c(H2SO3),0-t1段发生反应的离子方程式为:2S2O42-+O2+2H2O=4HSO3-,t1-t2段溶液的pH变小的原因是:亚硫酸氢钠被氧化生成硫酸氢钠,反应的离子方程式:2HSO3-+O2=2H++2SO42-,故答案为:c(HSO3-)>c(SO32-)>c(H2SO3);2S2O42-+O2+2H2O=4HSO3-;2HSO3-+O2=2H++2SO42-。


科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程中Fe2(SO4)3可循环利用
B.由脱硫过程可知,氧化性强弱Fe2(SO4)3<S<O2
C.脱硫过程中O2间接氧化H2S
D.副产物硫单质可以用来制硫酸、化肥、火柴及杀虫剂等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
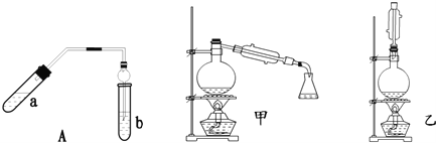
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
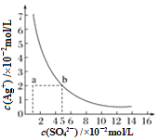
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能固氮反应条件苛刻,计算机模拟该历程如图所示,在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的( )
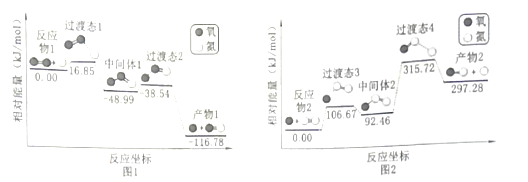
A.图1中,中间体1到产物1的方程式为O-O═N→O+N═O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72kJmol-1
D.由N和O2制NO的过程比由O原子和N2制NO的过程速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。
①ΔH=__kJ/mol。
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有___(填字母)。
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。
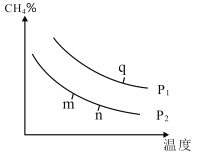
①p1___p2(填“<”、“>”或“=”),该反应为___(填吸或放)热反应。
②m、n、q三点的化学平衡常数大小关系为__。
③若q点对应的纵坐标为30,此时甲烷的转化率为___,该条件下的化学平衡常数Kp=___(用含有P1的表达式表示,Kp为以分压表示的平衡常数)。
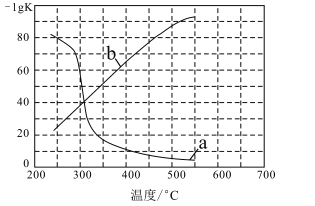
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的___(填a、b),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
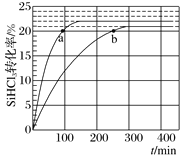
A.该反应的△H>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A-F是几种典型有机代表物的分子模型,请看图回答下列问题。
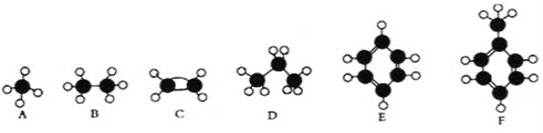
(1)常温下含碳量最高的是________(填对应字母);
(2)A、B、D三种物质的关系为____________
(3)写出F与浓硝酸和浓硫酸的混合物共热生成TNT的反应方程式__________
(4)写出E与溴反应的化学方程式________________;
(5)写出C使溴水褪色的方程式 ___________
(6)写出C的官能团的名称______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com